
����Ŀ���������߷ֱ��ʾԪ�ص�ij��������˵�����Ĺ�ϵ��ZΪ�˵������YΪԪ�ص��й����ʣ���
��1�����������Ԫ���й�������������ߵı��������Ӧ�����У�a.��A��Ԫ�ص����������� ��
b.��������Ԫ�ص�����ϼ� ��
c.������������Na+��Mg2+��Al3+��P3����S2����Cl�������Ӱ뾶 ��
d.�ڶ���������Ԫ����ԭ����������ԭ�Ӱ뾶�ı仯 ��
��2�������������ʣ��� ![]() C����
C���� ![]() K����
K���� ![]() Ca����
Ca���� ![]() C����
C���� ![]() N����
N���� ![]() Ar�����У� a.��Ϊͬλ�ص��� ��
Ar�����У� a.��Ϊͬλ�ص��� ��
b.��������ȣ������ܻ���ͬλ�ص��� ��
c.��������ȣ�������������ȵ��� ��
���𰸡�
��1��B��C��E��G
��2���٢ܣ��ۢޣ��ںۣ͢��ܺ͢�
���������⣺��1����a.ͬһ����Ԫ�ؼ۵�������ȣ���ԭ�������أ���IIA��Ԫ�ؼ۵���������2�����Դ��ǣ�B��b.��������Ԫ�ص���������ϼ�����ԭ���������������ϡ������Ļ��ϼ�Ϊ0�����Դ��ǣ�C��c.���Ӳ�Խ�࣬���Ӱ뾶Խ���Ӳ�ṹ��ͬ�����������Ӱ뾶����ԭ�������������С��Na+��Mg2+��Al3+�����Ӱ뾶���μ�С��P3����S2����Cl�������Ӱ뾶���μ�С�������Ӱ뾶���������Ӱ뾶������E���ϣ����Դ��ǣ�E��d.���Ӳ�Խ�࣬�뾶Խ�������ڵ�ԭ�Ӱ뾶���ڵڶ����ڣ�ͬ����ԭ�Ӱ뾶����ԭ�������������С������G���ϣ�
���Դ��ǣ�G����2���� ![]() C��������Ϊ6��������Ϊ12��������=12��6=6��
C��������Ϊ6��������Ϊ12��������=12��6=6��
�� ![]() K��������Ϊ19��������Ϊ39��������Ϊ39��19=20��
K��������Ϊ19��������Ϊ39��������Ϊ39��19=20��
�� ![]() Ca��������Ϊ20��������Ϊ40��������Ϊ40��20=20��
Ca��������Ϊ20��������Ϊ40��������Ϊ40��20=20��
�� ![]() C��������Ϊ6��������Ϊ13��������Ϊ13��6=7��
C��������Ϊ6��������Ϊ13��������Ϊ13��6=7��
�� ![]() N��������Ϊ7��������Ϊ14��������Ϊ14��7=7��
N��������Ϊ7��������Ϊ14��������Ϊ14��7=7��
�� ![]() Ar��������Ϊ18��������Ϊ40��������Ϊ40��18=22�� a.��Ϊͬλ�ص��Ǣ٢ܣ����Դ��ǣ��٢ܣ�b.��������ȣ������ܻ���ͬλ�ص��Ǣۢޣ����Դ��ǣ��ۢޣ�c.��������ȣ�������������ȵ��Ǣںۣ͢��ܺ͢ݣ����Դ��ǣ��ںۣ͢��ܺ͢ݣ�
Ar��������Ϊ18��������Ϊ40��������Ϊ40��18=22�� a.��Ϊͬλ�ص��Ǣ٢ܣ����Դ��ǣ��٢ܣ�b.��������ȣ������ܻ���ͬλ�ص��Ǣۢޣ����Դ��ǣ��ۢޣ�c.��������ȣ�������������ȵ��Ǣںۣ͢��ܺ͢ݣ����Դ��ǣ��ںۣ͢��ܺ͢ݣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л��ﺬ̼85.7%������14.3%����80g����5%����ˮ��ͨ����л����ˮǡ����ȫ��ɫ����ʱҺ��������Ϊ81.4g����
��1���л���ķ���ʽ��
��2�����ⶨ�����л����������������CH3 �� ��д�����Ľṹ��ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з���������ԭ�Ӿ����������8���ӽṹ����
A. LiClB. NCl3C. PCl5D. BF3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£������ܱ������н��еķ�ӦP��g��+Q��g��![]() R��g��+S��g������˵���п��Գ��˵����һ��Ӧ�Ѿ��ﵽ��ѧƽ��״̬���ǣ� ��
R��g��+S��g������˵���п��Գ��˵����һ��Ӧ�Ѿ��ﵽ��ѧƽ��״̬���ǣ� ��
A. P��Q��R��S��Ũ�����
B. P ��Q��R��S���ܱ������й���
C. P��Q��R��S��Ũ�Ȳ��ٱ仯
D. ��P��Ũ�ȱ仯��ʾ�Ļ�ѧ��������Q��Ũ�ȱ�ʾ�Ļ�ѧ��Ӧ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2����Դ�������ǽ������ЧӦ����Ҫ;������ͼ����һ����������NH3����CO2������Ҫ������Ʒ��������ķ�Ӧ�� 
�����й����������˵����ȷ���ǣ� ��
A.����ʽΪC3H6N3O3
B.�����мȺ����Լ����ֺ��Ǽ��Լ�
C.���ڹ��ۻ�����
D.���ɸ����ʵ�������ӦΪ�кͷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��Q��R��Ϊǰ������Ԫ�أ���ԭ���������������������Ϣ���±���ʾ��
XԪ�صĻ�̬ԭ���е��ӷֲ���������ͬ���ܼ��У���ÿ���ܼ��еĵ���������ͬ |
YԪ�ص���̬�⻯����������������Ӧ��ˮ�����ܷ������Ϸ�Ӧ |
ZԪ�ص����������������������� |
Wԭ�ӵĵ�һ�����������ֱܷ�Ϊ��I1=578KJmol��1 I2=1817KJmol��1 I3=2745KJmol��1I4=11575KJmol��1 I5=14830KJmol��1 I6=18376KJmol��1 |
QΪǰ�������е縺����С��Ԫ�� |
Ԫ��Rλ�����ڱ��ĵ�10�� |
�ش��������⣺
��1��YԪ�صĻ�̬ԭ����δ�ɶԵ�����Ϊ��X��Y��Z����Ԫ��ԭ�ӵĵ�һ��������С�����˳��Ϊ����Ԫ�ط��ű�ʾ����
��2��W���Ȼ�����۵��Q���Ȼ�����۵�����ߡ��͡�����������
��3������֤ʵԪ��W�ĵ�����ǿ������Һ��Ӧ��[W��OH��4]�����ɣ���[W��OH��4]���д��ڣ�����ĸ�� �� a�����Թ��ۼ� b���Ǽ��Թ��ۼ� c����λ�� d�����
��4������X��R��þ����Ԫ�ص�ij�־�����г����ԣ���ṹ��ͼ��ʾ����þ���Ļ�ѧʽΪ��������ÿ��þԭ����Χ���������Rԭ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش��������⣺
��1����ͼΪ�������ӵĽṹʾ��ͼ�����������գ�
���������ӽṹ��������������ĸ��ţ���ͬ����A���ӵİ뾶B���ӵİ뾶�����������������=������
��2���л���M����̫������տ�ת����N��ת���������£� 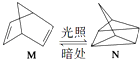 ��H=+88.6kJmol��1��M��N��ȣ����ȶ����� ��
��H=+88.6kJmol��1��M��N��ȣ����ȶ����� ��
��3����������������Ӧ����1molˮ�����ų�����241.8kJ��д���÷�Ӧ���Ȼ�ѧ����ʽΪ�� ��
��4��һ���¶�����ij���������з�����Ӧ��2A��g��+3B��g��2C��g������ʼʱ��A��Ũ��Ϊ2molL��1 �� B��Ũ��Ϊ4molL��1 �� 2min��A��Ũ�ȼ���0.8molL��1 �� ���v��B��= �� v��C��= ��
����2minĩ��C��Ũ���� �� B��Ũ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ֽ���β��[��Ҫ�ɷ�ΪCa5(PO4)3F]���Ƶ���ǿ������H3PO4����ش�
��1��Na2HPO4��Һ�ʼ��ԣ����ڸ���Һ��c(H2PO4��)_____c(PO43��)������>������<����������������Na2HPO4��Һ�м���������CaCl2��Һ����Һ�����ԣ���Һ�����Ե�ԭ����(�ӵ���ƽ���ƶ��Ƕȷ���)��________________________��
��2��Ca5(PO4)3F(s) +OH��(aq)![]() Ca5(PO4)3(OH) (s)+F�������¶��£���Һ��c(F��)����Һ��pH���¶ȣ�T���ı仯������ͼ��ʾ��
Ca5(PO4)3(OH) (s)+F�������¶��£���Һ��c(F��)����Һ��pH���¶ȣ�T���ı仯������ͼ��ʾ��
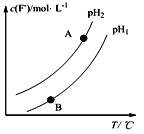
���ʵ�______�¶���������β��ת��Ϊ�ǻ���ʯ��������������������������pH1___pH2������>������<��������������A��B�������Һ��F��������v(A)____v(B)������>���� ��<��������������
��3����֪��25��ʱ��H3PO4�ĵ���ƽ�ⳣ����K1��7.52��10��3��K2��6.23��10��8��K3��6.23��10��13����H3PO4(aq)+OH��(aq)![]() H2PO4��(aq)+H2O (l)��ƽ�ⳣ��K=____________��
H2PO4��(aq)+H2O (l)��ƽ�ⳣ��K=____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ֱ���������Һ�м��������Ĺ������ƹ��壬������ֻ��ǵ��� ( )
A��Na2CO3��Һ
B��FeCl3��Һ
C������Ca(OH)2��Һ
D��CuSO4��Һ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com