
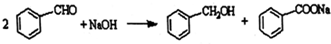

分析 Ⅰ、(1)根据可逆反应R-CHO+NaHSO3?R-CH(OH)-SO3Na,要想使CH3CH(OH)-SO3Na全部变成乙醛即使平衡向逆反应方向移动,可以采取加入氢氧化钠或者盐酸消耗亚硫酸钠使平衡逆向移动;分离互溶的有机物采用蒸馏的方法;
Ⅱ、由流程可知,苯甲醛与KOH反应生成苯甲醇、苯甲酸钾,然后加水、乙醚萃取苯甲醇,操作Ⅰ分层乙醚与水溶液,则为萃取分液,则乙醚溶液中含苯甲醇,操作II为蒸馏,得到产品甲为苯甲醇;水溶液中含苯甲酸钾,加盐酸发生强酸制取弱酸的反应,生成苯甲酸,苯甲酸的溶解度小,则操作Ⅲ为过滤,则产品乙为苯甲酸,以此来解答.
解答 解:Ⅰ、(1)因为可逆反应R-CHO+NaHSO3?R-CH(OH)-SO3Na,要想使CH3CH(OH)-SO3Na全部变成乙醛即使平衡向逆反应方向移动,可以采取加入氢氧化钠或者盐酸消耗亚硫酸钠使平衡逆向移动,所以可以加入的为NaOH或者HCl;分离互溶的有机物采用蒸馏的方法,所以分离乙醛的操作方法为蒸馏,
故答案为:NaOH;HCl;蒸馏;
Ⅱ、由流程可知,苯甲醛与KOH反应生成苯甲醇、苯甲酸钾,然后加水、乙醚萃取苯甲醇,操作Ⅰ分层乙醚与水溶液,则为萃取分液,则乙醚溶液中含苯甲醇,操作II为蒸馏,得到产品甲为苯甲醇;水溶液中含苯甲酸钾,加盐酸发生强酸制取弱酸的反应,生成苯甲酸,苯甲酸的溶解度小,则操作Ⅲ为过滤,则产品乙为苯甲酸;
(2)根据以上分析,操作Ⅰ分层乙醚与水溶液,则为萃取分液,乙醚溶液中所溶解的主要成分是苯甲醇,故答案为:萃取分液;苯甲醇;
(3)根据以上分析,操作Ⅲ的名称是过滤,产品乙是苯甲酸,故答案为:过滤;苯甲酸;
(4)根据苯甲醛与KOH反应生成苯甲醇、苯甲酸钾,所得混合物中可能还有未反应的苯甲醛,然后加水、乙醚萃取苯甲醇和未反应的苯甲醛,则乙醚溶液中含苯甲醇和未反应的苯甲醛,所以操作II为蒸馏,得到产品甲为苯甲醇和未反应的苯甲醛,根据醛类是重要的工业原料,可以跟亚硫酸氢钠饱和溶液发生加成反应,生成是α-羟基磺酸钠(易溶于水,不溶于饱和亚硫酸氢钠溶液),所以可以通过取少量产品甲于试管中,向试管中滴加适量的饱和NaHSO3溶液,如果有晶体析出,说明含有苯甲醛,
故答案为:苯甲醛;取少量产品甲于试管中,向试管中滴加适量的饱和NaHSO3溶液,如果有晶体析出,说明含有苯甲醛.
点评 本题考查有机物的分离提纯,为高频考点,把握有机物的性质及分离流程中的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
 异构化可得到三元乙丙橡胶的第三单体
异构化可得到三元乙丙橡胶的第三单体 .
. 由A(C5H6)和B经Diels-Alder反应制得.Diels-Alder反应为共轭双烯与含有烯键或炔键的化合物相互作用生成六元环状化合物的反应,最简单的反应是
由A(C5H6)和B经Diels-Alder反应制得.Diels-Alder反应为共轭双烯与含有烯键或炔键的化合物相互作用生成六元环状化合物的反应,最简单的反应是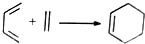 .
. .
.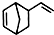 互为同分异构体,且一溴代物只有两种的芳香烃的名称:1,3,5-三甲基苯;写出生成这两种一溴代物所需要的反应试剂和反应条件:催化剂和液溴、光照和溴蒸气.
互为同分异构体,且一溴代物只有两种的芳香烃的名称:1,3,5-三甲基苯;写出生成这两种一溴代物所需要的反应试剂和反应条件:催化剂和液溴、光照和溴蒸气.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数 | 1.8×10-4 | 4.9×10-11 | Ki=1.3×10-1 Kr=7.1×10-15 |
| A. | 等物质的量浓度的各溶液pH关系为pH(CH3COONa)>pH(Na2S)>pH(NaCN) | |
| B. | amol/LHCN与bmol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于或等于b | |
| C. | NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) | |
| D. | 某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-dmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,电极铝和镁都已除去表面氧化膜.当两装置电路中通过的电子都是1mol时,下列说法不正确的是( )
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,电极铝和镁都已除去表面氧化膜.当两装置电路中通过的电子都是1mol时,下列说法不正确的是( )| A. | 溶液的质量减小程度:乙<甲 | |
| B. | 溶液的导电能力变化:甲>乙 | |
| C. | 甲中阴极和乙中镁电极上析出物质质量:甲=乙 | |
| D. | 电极反应式:甲中阳极:2Cl--2e→Cl2↑,乙中正极:Cu2++2e→Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 臭氧比氧气稳定 | B. | 臭氧分解的反应速率由步骤①决定 | ||
| C. | 反应的活化能等于285kJ•mol-1 | D. | 氧原子是该反应的催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入BaCl2溶液中 | B. | 将Cl2通入AgNO3溶液中 | ||
| C. | 将CO2通入Ba(OH)2溶液中 | D. | 将NO2通入Ca(OH)2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 A、B、C、D、E各物质的转化关系如图所示.
A、B、C、D、E各物质的转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3的电子式: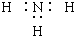 | |
| B. | 氯气的化学式:Cl | |
| C. | 氮气的电子式: | |
| D. | 硫酸铝的电离方程式:Al2(SO4)3═Al3++SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com