
钡是元素周期表中第七周期的ⅡA族元素。下面关于钡的性质的描述中不正确的是( )
A 在化合物中呈+2价 B 单质与水剧烈反应、放出氢气
C 氢氧化物呈两性 D 碳酸盐难溶于水
科目:高中化学 来源: 题型:
已知X、Y、Z、W四种元素原子序数依次增大,它们的结构、性质信息如下表:
| 元素 | 结构、性质信息 |
| X | 最外层电子数等于次外层电子数 |
| Y | 单质在常温下是固体,基态原子的M层上有1个未成对的p电子 |
| Z | 元素正三价离子的3d能级为半充满 |
| W | 元素基态原子的M层全充满,N层只有一个电子 |
(1)元素Y的原子核外共有 种不同运动状态的电子。
(2)Z元素基态原子的价电子排布式 。
(3)以上四种元素的单质中可与NaOH溶液反应的是 。(填元素符号)
(4)向WSO4溶液中逐渐滴加氨水,观察到 ,
相关的离子方程式 。
(5)灼烧铜丝时会产生绿色火焰,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g)
ΔH1=+49.0 kJ/mol;
②CH3OH(g)+ O2(g)===CO2(g)+2H2(g)
O2(g)===CO2(g)+2H2(g)
ΔH2=-192.9 kJ/mol。
根据上述反应,下列说法正确的是( )
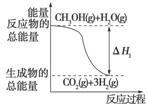
A.反应①中的能量变化如上图所示
B.CH3OH转变成H2的过程一定要吸收能量
C.1 mol CH3OH充分燃烧放出的热量为192.9 kJ
D.可推知2H2(g)+O2(g)===2H2O(g)
ΔH=-483.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数,下列说法中正确的是 ( )
A. 1molNa2O2固体中含阴离子个数为2NA B. 1molSiO2中含Si-O的数目为2NA
C. 标准状况下,22.4L乙炔中含π键数为2NA D. 1molNaHCO3晶体中阳离子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.Ca2+的核外电子排布式为1s22s22p63s23p6 4s2
B.铁原子的价电子排布图为:
C.某原子的核外电子排布式为1s22s22p63s23p63d54s1 ,则其成单电子数为2
D.各能级的原子轨道数按s、p、d、f的顺序依次为1、3、5、7
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲醇合成反应及其能量变化如图所示:(1)写出合成甲醇的热化学方程式___________________________________________。
甲醇合成反应及其能量变化如图所示:(1)写出合成甲醇的热化学方程式___________________________________________。
实验室在1 L的密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300 ℃和500 ℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
| 时间浓度(mol/L)温度 | 10 min | 20 min | 30 min | 40 min | 50 min | 60 min |
| 300 ℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500 ℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
(2)在300 ℃反应开始10 min内,CO的平均反应速率为v(CO)=________________。
(3)在500 ℃达到平衡时,平衡常数K=________。
(4)在另一体积不变的密闭容器中,充入1.6 mol CO和2.0 mol H2,一定条件下达到平衡,测得容器中压强为起始压强的一半。计算该条件下H2的转化率为________。
(5)美国科学家成功开发便携式固体氧化物燃料电池,该燃料电池中一极通入空气,另一极通入甲醇气体,电解质是固态氧化物,在熔融状态下能传导O2—。在电路中每流过30 mol电子,有 mol甲醇被完全氧化;在燃料电池中通甲醇的电极发生的电极反应为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O 的物质的量随着混合烃物质的量的变化如图所示:

则下列对混合烃的判断正确的是
①一定有C2H4 ②一定有CH4 ③一定有C3H8
④一定没有C2H6 ⑤可能有C2H2 ⑥可能有C3H4
A. ②③ B.②④ C.②⑤⑥ D.②④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com