
 电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如表所示:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如表所示:| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数(Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
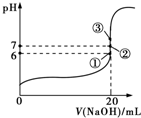
分析 (1)HF是弱电解质,加水稀释能够促进HF的电离,但c(H+) 降低.温度不变,KW不变,c(OH-) 升高,据此分析;
(2)A.酸能抑制水的电离,含有弱根离子的盐能促进水的电离;
B.据电荷守恒c(F-)-c(Na+)=c(H+)-c(OH-);
C.据电荷守恒,溶液呈中性,氢离子浓度等于氢氧根浓度,所以氟离子浓度等于钠离子浓度;
D.③点时V=20 mL,溶液呈碱性,根据溶液呈电中性知,钠离子浓度大于氟离子浓度;
(3)据盐类水解原理中的越弱越水解判断;
(4)CO32-能够与钡离子反应生成碳酸钡沉淀;
(5)HFO与水反应得到HF和化合物双氧水,据此分析.
解答 解:(1)A、加水稀释能促进氢氟酸的电离,溶液中氢离子浓度降低,故A错误;
B、温度不变,水的离子积常数不变,故B错误;
C、溶液中氢离子浓度和氢氟酸浓度都降低,该分式中都乘以氟离子浓度得氢氟酸的电离常数除以负离子浓度,电离常数不变,负离子浓度减小,所以其比值增大,故C正确;
D、溶液中氢氧根离子浓度增大,氢离子浓度减小,故D正确;
故答案为:CD;
(2)A.酸能抑制水的电离,含有弱根离子的盐能促进水的电离,故A错误;
B.c(F-)-c(Na+)=c(H+)-c(OH-),故B正确;
C.溶液呈中性,氢离子浓度等于氢氧根浓度,所以氟离子浓度等于钠离子浓度,故C正确;
D.③点时V=20 mL,溶液呈碱性,根据溶液呈电中性知,钠离子浓度大于氟离子浓度,故D错误;
故答案为:BC;
(3)根据相应酸的酸性强弱判断,氢氟酸的酸性大于碳酸的,碳酸的酸性大于次氯酸的,所以顺序为①④②③(或①>④>②>③,用物质名称表示也对),
故答案为:①④②③(或①>④>②>③,用物质名称表示也对);
(4)在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后,碳酸根离子能够与钡离子反应生成碳酸钡沉淀,碳酸根离子浓度降低,若红色褪去或变浅,可以证明,故答案为:在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅;
(5)HFO与水反应生成氢氟酸和双氧水,每生成1 mol HF转移2 mol电子,故答案为:2.
点评 本题考查了弱电解质的电离、盐类水解、电解质溶液中的电荷守恒以及氧化还原反应中的电子守恒,题目难度不大.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 右图是常见于汽车中的小摆件“苹果花”,它的动力是以Si为原料制作的太阳能电池 | |
| B. | 玻璃上的精美刻花,是工艺师用盐酸刻蚀玻璃形成的 | |
| C. | 互联网通过光纤交换信息,光纤的主要原料是SiO2 | |
| D. | 因为玻璃中含有SiO2,所以不能用磨口玻璃塞的试剂瓶盛装碱性溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com