
分析 探究浓度对反应速率的影响,要让其他条件完全相同,只有浓度不同,所以要保证镁带完全一样,放在两只大小一致的试管中,加入相同体积不同浓度的硫酸溶液,保证相同温度,记录开始反应至结束所需的时间.
解答 解:探究浓度对反应速率的影响,要让其他条件完全相同,只有浓度不同,所以要保证镁带完全一样,放在两只大小一致的试管中,加入相同体积不同浓度的硫酸溶液,保证相同温度,记录开始反应至结束所需的时间,方案如下:
①取两支试管,向其中一支试管加入4mL1.0mol/L稀硫酸,另一支试管加入2mL 1.0mol/L稀硫酸和2mL蒸馏水,振荡混匀,将两支试管置于恒温水浴中;
②剪取长度相同的用砂纸打磨过的2段镁带;
③将两段镁带分别置于两支试管中,并用秒表记录镁带从投入到消失所需要的时间;
故答案为:①取两支试管,向其中一支试管加入4mL1.0mol/L稀硫酸,另一支试管加入2mL 1.0mol/L稀硫酸和2mL蒸馏水,振荡混匀,将两支试管置于恒温水浴中;
②剪取长度相同的用砂纸打磨过的2段镁带;
③将两段镁带分别置于两支试管中,并用秒表记录镁带从投入到消失所需要的时间.
点评 本题考查了探究影响反应速率的因素,实验方案的设计,难度一般,注意试验过程中单一变量研究方法的使用,为易错点.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属性:K>Na>Li | B. | 酸性:HClO3>H2SO4>H3PO4 | ||
| C. | 还原性:I->Br->Cl- | D. | 氧化性:F2>Cl2>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| A | ①能使溴的四氯化碳溶液褪色 ②比例模型为 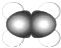 ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成 ②球棍模型为 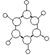 |
| C | ①由C、H、O三种元素组成 ②能与Na反应 ③与E反应生成相对分子质量为88的酯 |
| D | ①相对分子质量比C少2 ②能由C催化氧化得到 |
| E | ①由C、H、O三种元素组成 ②其水溶液能使紫色石蕊试液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 试剂或操作 | |
| 鉴别乙醇和乙酸 | 紫色石蕊试液(Na2CO3溶液、NaHCO3溶液) |
| 鉴别棉花和蚕丝 | 灼烧 |
| 除去乙烷中混有的乙烯 | 溴水(溴的CCl4溶液) |
| 除去苯中溶解的溴单质 | NaOH溶液 |
| 海水淡化 | 蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 能源是现代社会发展的支柱之一.
能源是现代社会发展的支柱之一.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
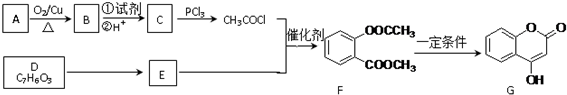
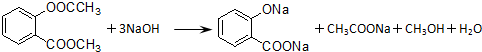 .
. .
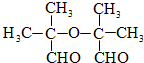
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com