
| A. | 热稳定性H2O>H2S | B. | 还原性Ⅰ->Br->Cl- | ||
| C. | 金属性 K>Na | D. | 酸性 HCl>HF |
分析 A.非金属性越强,氢化物越稳定;
B.非金属性越强,对应离子的还原性越弱;
C.同主族,从上到下金属性增强;
D.非金属性F>Cl,但HF为弱酸.
解答 解:A.非金属性O>S,则热稳定性H2O>H2S,能用元素周期律解释,故A正确;
B.非金属性Cl>Br>I,则还原性Ⅰ->Br->Cl-,能用元素周期律解释,故B正确;
C.同主族,从上到下金属性增强,则金属性 K>Na,能用元素周期律解释,故C正确;
D.非金属性F>Cl,但HF为弱酸,HCl为强酸,不能用元素周期律解释,故D错误;
故选D.
点评 本题考查元素的性质及元素周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Cl-、Mg2+、NO3- | B. | K+、Cl-、Mg2+、SO42- | ||
| C. | Fe3+、Na+、NO3-、Al3+ | D. | HCO3-、NH4+、Ag+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是其它化学知识的载体.
高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是其它化学知识的载体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 含量/(mg/L) | 成分 | 含量/(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
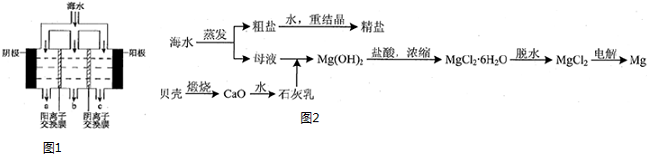
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,64 g SO2含有的原子数目为NA | |
| B. | 常温常压下,22.4 L O2含有的分子数目为NA | |
| C. | 1 mol镁与足量稀硫酸反应时失去的电子数目为2 NA | |
| D. | 1 mol•L-1K2SO4溶液中含有的钾离子数目为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐 | B. | 火碱 | C. | 草木灰 | D. | 胆矾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z单质还原性大于Y单质 | |
| B. | X的氢化物沸点高于W的氢化物 | |
| C. | 仅含X、Y两元素的化合物均只含离子键 | |
| D. | 上述四种元素形成的简单离子中,X离子半径最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,2.24LSO2与O2混合气体中所含氧原子数为0.2NA | |
| B. | 50mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 标准状况下,20gD20分子中所含中子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com