
分析下列溶液蒸干后得到的固体是什么?写出化学式:
(1)K2CO3溶液蒸干得到的固体物质是________.
(2)(NH4)2SO4溶液蒸干得到的固体物质是________.
(3)Ba(HCO3)2溶液蒸干得到的固体物质是________.
(4)Na2SO3溶液蒸干得到的固体物质是________.
(5)Mg(HCO3)2溶液蒸干得到的固体物质是________.
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2007届江苏省南菁、梁丰、前黄中学三校联考试卷、化学 题型:038
| |||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源:启东市汇龙中学迎二模模拟考试(二)、化学 题型:038
| |||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市虹口区高三上学期期末教学质量调研化学试卷(解析版) 题型:实验题
精制氯化钾在工业上可用于制备各种含钾的化合物。完成下列填空:
(1)工业氯化钾中含有Fe3+、SO42—、Br—等杂质离子,可按如下步骤进行精制,完成各步内容。
①溶解;②加入试剂至Fe3+、SO42—沉淀完全,煮沸;③_____________________;④加入盐酸调节pH;
⑤___________________(除Br—);⑥蒸干灼烧。
步骤②中,依次加入的沉淀剂是NH3·H2O、________、________。
证明Fe3+已沉淀完全的操作是_________________________________________________。
(2)有人尝试用工业制纯碱原理来制备K2CO3。他向饱和KCl溶液中依次通入足量的______和______两种气体,充分反应后有白色晶体析出。将得到的白色晶体洗涤后灼烧,结果无任何固体残留,且产生的气体能使澄清石灰水变浑浊。
写出生成白色晶体的化学方程式:___________________________________________。
分析该方法得不到K2CO3的原因可能是_______________________________________。
(3) 用氯化钾制备氢氧化钾的常用方法是离子交换膜电解法。氢氧化钾在_________极区产生。为了避免两极产物间发生副反应,位于电解槽中间的离子交换膜应阻止_______(填“阴”、“阳”或“所有”)离子通过。
(4)科学家最近开发了一种用氯化钾制氢氧化钾的方法。其反应可分为5步(若干步已合并,条件均省略)。请写出第⑤步反应的化学方程式。
第①、②步(合并):2KCl + 4HNO3 → 2KNO3 + Cl2 + 2NO2 + 2H2O
第③、④步(合并):4KNO3 + 2H2O → 4KOH + 4NO2 + O2
第⑤步:____________________________________________
总反应:4KCl + O2 + 2H2O → 4KOH + 2Cl2
与电解法相比,该方法的优势可能是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
往200mL NaOH溶液中通入CO2,充分反应后,在减压和低温下,小心将溶液蒸干,得白色固体M。通入CO2的体积V(CO2)(mL)(标准状况下)与M的质量(g)的关系如下图。试通过分析和计算回答下列问题(要求写出简要计算过程):
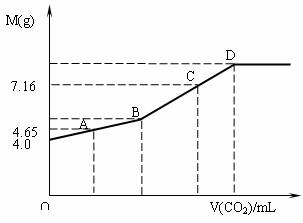
(1)B点时,白色固体M的化学式_________,通入CO2的体积为______________mL。
(2)D点时,通入CO2的体积为__________mL。
(3)C点时,通入CO2的体积为__________mL。
(4)取组成为A点的白色固体1/10,向其中逐滴加入0.1mol/LHCl溶液,请在下图中画出产生CO2气体体积(标准状况下)与所加入的盐酸的体积关系、:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com