
| A、21:5 | B、11:3 |
| C、3:1 | D、4:1 |


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
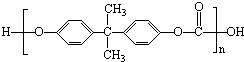 2010年5月1日上海世博会隆重开幕,世博会的环保概念是人们关心的话题,环保材料更为世人瞩目,其中聚碳酸酯是用得较多的材料.聚碳酸酯的结构简式如图所示,下列说法正确的是( )
2010年5月1日上海世博会隆重开幕,世博会的环保概念是人们关心的话题,环保材料更为世人瞩目,其中聚碳酸酯是用得较多的材料.聚碳酸酯的结构简式如图所示,下列说法正确的是( )| A、它在结构上可以看成由碳酸和另一有机物通过缩聚反应而成 |
| B、该有机物是一种高分子化合物,肯定易溶于水 |
| C、它是一种纯净物,属于酯类物质 |
| D、它耐强酸,强碱,不可与强氧化剂发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:W>Y>Z>X |
| B、气态氢化物的稳定性:X>Z |
| C、金属性:Y<W |
| D、Y、Z的氧化物都能和酸或碱反应,都是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、F2、Cl2、Br2、I2的熔点依次升高 |
| B、Li、Na、K、Rb的熔点依次降低 |
| C、NaF、NaCl、NaBr、NaI的熔点依次降低 |
| D、晶体硅、碳化硅、金刚石熔点依次升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、祖母绿是一种硅酸盐矿物 |
| B、其主要成分可用氧化物形式表示:3BeO?Al2O3?6SiO2 |
| C、绿色是Cr2O3表现出来的 |
| D、祖母绿是多种氧化物组成的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
| A、-218kJ/mol |
| B、-436kJ/mol |
| C、+218kJ/mol |
| D、+436kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:3 | B、1:1 |
| C、1:2 | D、1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B、含1 mol Ba(OH)2的稀溶液和含1 mol H2SO4的稀溶液反应释放热量akJ,则表示该反应中和热的热化学反应方程式为:OH-(aq)+H+(aq)═H2O(l) H=-a kJ?mol-1 |
| C、电解精炼铜时,电解初同一时间内,阳极溶解铜的质量比阴极析出铜的质量小 |
| D、对于2HI(g)?H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com