
| A.2 mol | B.3 mol | C.4 mol | D.6 mol |
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源:不详 题型:填空题



查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na2O2既是氧化剂又是还原剂 |
| B.Na2FeO4既是氧化产物又是还原产物 |
| C.3 mol Na2O2发生反应,有12 mol电子转移 |
| D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
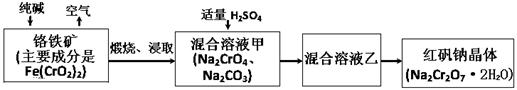
 2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (NxOy)+ H2O(配平时x、y用具体数值表示,物质填在
(NxOy)+ H2O(配平时x、y用具体数值表示,物质填在 中)。
中)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.②③ | C.①③ | D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO(NH2)2 (l)+ H2O (l)。
CO(NH2)2 (l)+ H2O (l)。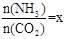 ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。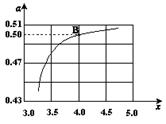
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 。 反应①的化学方程式为 ;
。 反应①的化学方程式为 ;查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该反应说明Fe(NO3)2溶液不宜加酸酸化 |
| B.该反应中氧化剂与还原剂物质的量之比为8:1 |
| C.若有1mol NO3—发生氧化反应,转移电子5mol |
| D.若将该反应设计成原电池,则负极反应为Fe3++e—=Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com