
| A. | 6.02×1023 | B. | 12C原子质量的十二分之一 | ||
| C. | 0.012Kg12C所含的原子数 | D. | 1mol氧气所含的微粒数 |
分析 R分子的相对质量为M,故可知R的摩尔质量为Mg/mol,即1molR的质量为Mg,由于一个R分子的质量为ag,故可知$\frac{M}{a}$的意义是在1molR中即MgR中含有的R分子的个数,据此分析.
解答 解:R分子的相对质量为M,故R的摩尔质量为Mg/mol,即1molR的质量为Mg,而一个R分子的质量为ag,故$\frac{M}{a}$的意义是在MgR中即1molR中所含有的R分子的个数,即6.02×1023个,即0.012Kg12C所含的原子数,故AC正确.
故选AC.
点评 本题考查了阿伏伽德罗常数的计算和含义,应注意的是1mol物质中含有NA个微粒,即NA个微粒的质量之和即1mol物质的质量.难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 无气味 | B. | 能溶于水 | C. | 能与水反应 | D. | 能与铜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(4) | B. | (4)(3) | C. | (1)(2) | D. | (2)(3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
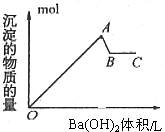
| A. | OA段的反应离子方程式为:2Al3++3SO42-+3Ba2++6OH-→2Al(OH)3↓+3BaSO4↓ | |
| B. | AB段的离子方程式只有:Al(OH)3+OH-→AlO2-+2H2O | |
| C. | A点的沉淀为Al(OH)3和BaSO4的混合物 | |
| D. | B点溶液为KAlO2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
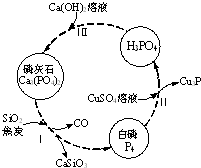 磷及部分重要化合物的相互转化如图所示.
磷及部分重要化合物的相互转化如图所示.| 成分 | CaO | P2O5 | SO3 | CO2 |
| 质量分数(%) | 47.30 | 28.40 | 3.50 | 6.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Kw>1×10-14 | B. | 水电离的c(H+)>1×10-13 mol/L | ||
| C. | pH>13 | D. | c(OH-)=c(H+)+c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | S2-+Cu2+→CuS↓ | B. | 2HS-+Cu2+→CuS↓+2H++S2- | ||
| C. | HS-+Cu2+→CuS↓+H+ | D. | 2HS-+Cu2+→CuS↓+H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b | B. | HA与BOH的电离常数相等 | ||
| C. | 混合溶液中,c(H+)=$\sqrt{{K}_{W}}$mol/L | D. | 混合溶液中,c(H+)+c(B+)═c(OH-)+c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com