
| A. | Q>Q1>2Q2 | B. | Q2<Q1<2Q2 | C. | Q=Q1>Q2 | D. | Q1=2Q2 |
分析 2SO2(g)+O2(g)?2SO3(g),△H=-QkJ/mol,表示在上述条件下2mol SO2和1molO2完全反应生成1molSO3气体放出热量为QkJ,再结合可逆反应中反应物不能完全反应解答.
解答 解:反应的热化学方程式为:2SO2(g)+O2(g)?2SO3(g)△H=-QkJ/mol,
由热化学方程式可知,在上述条件下反应生成2molSO3气体放热QkJ,加入2mol SO2和1molO2,生成的三氧化硫量小于2mol,所以Q1<Q,
通入1mol SO2和0.5molO2,如果转化率与加入2mol SO2和1molO2相同,则放热为$\frac{Q1}{2}$kJ,但是此时体系压强比加入2mol SO2和1molO2要小,所以平衡会向左移动,所以实际放出的热量<$\frac{Q1}{2}$kJ,即2Q2<Q1,综上得:2Q2<Q1<197kJ,所以2Q2<Q1<Q.
故选:A.
点评 本题考查反应热的计算,题目难度中等,本题注意浓度对平衡的影响以及可逆反应的特征.


科目:高中化学 来源: 题型:选择题
| A. | ①②③中加入过量的试剂是为了完全除去相应的杂质离子 | |
| B. | ③中加入过量Na2CO3溶液仅为了完全除去Ca2+ | |
| C. | 因为Mg(OH)2难溶而MgCO3微溶,所以用NaOH除Mg2+效果比用Na2CO3好 | |
| D. | ⑤中可以通过边滴加边测定溶液pH的方法,控制加入的盐酸“适量” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6L四氯化碳含有的分子数为0.25NA | |
| B. | 1.4g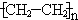 中含有的碳原子数为0.2NA 中含有的碳原子数为0.2NA | |
| C. | 1 mol苯分子中含有C=C双键数为3NA | |
| D. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成水分子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、Cl-、HCO3- | B. | Ba2+、Na+、SO42-、Cl- | ||
| C. | MnO4-、K+、S2-、H+ | D. | Mg2+、Cl-、NO${\;}_{3}^{-}$、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
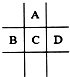 有A、B、C、D四种短周期元素,它们在周期表中的位置如图所示,已知四种元素核外共有56个电子,则以下说法不正确的是( )
有A、B、C、D四种短周期元素,它们在周期表中的位置如图所示,已知四种元素核外共有56个电子,则以下说法不正确的是( )| A. | A的氢化物在常温下通常为液态 | |
| B. | A的单质与C的某种化合物之间可能发生置换反应 | |
| C. | B、C、D的含氧酸酸性依次增强 | |
| D. | D的单质是制备漂白剂的重要原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 HNO3是极其重要的化工原料.工业上制备HNO3采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的. 据此完成下列试题:
HNO3是极其重要的化工原料.工业上制备HNO3采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的. 据此完成下列试题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种元素 | B. | 互为同位素 | C. | 同种核素 | D. | 同一原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
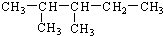
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、CO32-、K+、Na+ | B. | Na+、Ba2+、Cl-、HCO32- | ||
| C. | NO3-、Cu2+、K+、SO42- | D. | NO3-、K+、CO32-、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com