(2013?枣庄二模)实验室以工业碳酸钙(含少量Na
+、Al
3+、Fe
3+等杂质)为原料制取CaCl
2?2H
2O和CaO
2的主要流程如下:
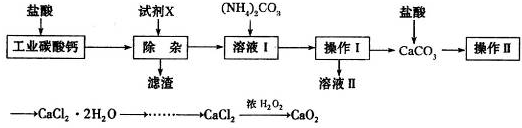
(1)加入试剂X,调节溶液pH为碱性环境,以除去溶液中Al
3+和Fe
3+,滤渣的主要成分是
Fe(OH)3、Al(OH)3
Fe(OH)3、Al(OH)3
.试剂X可以选择下列的
AB
AB
(填编号).
A.CaO B.CaCO
3 C.NH
3?H
2O D.Ba(OH)
2(2)操作II中进行蒸发浓缩时,除三角架、酒精灯外,还需要的仪器有
玻璃棒和蒸发皿
玻璃棒和蒸发皿
.
(3)由CaCl
2制取CaO
2的反应中,温度不宜太高的原因是
温度过高会导致双氧水分解
温度过高会导致双氧水分解
.
(4)用下列装置测定工业碳酸钙的质量分数
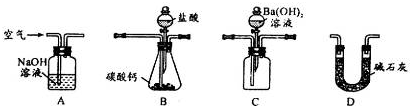
①检验装置B气密性良好的实验过程是
关闭导管出口以及分液漏斗的瓶塞,打开分液漏斗的旋塞,液体不往下滴,证明气密性良好
关闭导管出口以及分液漏斗的瓶塞,打开分液漏斗的旋塞,液体不往下滴,证明气密性良好
.
②按A-B-C-D顺序连接,然后从A装置通入空气,目的是
让生成的二氧化碳全部放出,进入C装置,确保实验结果的准确性
让生成的二氧化碳全部放出,进入C装置,确保实验结果的准确性
.
③装置D的作用为
防止空气中的二氧化碳进入装置C中,引起实验误差
防止空气中的二氧化碳进入装置C中,引起实验误差
.
④实验时,准确称取10.00g工业碳酸钙3份,进行3次测定,测得BaCO
3沉淀的平均质量为17.73g,则样品中CaCO
3的质量分数为
90.00%
90.00%
.





 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案