

 制备比
制备比 少2个氢原子的芳香烃的合成路线
少2个氢原子的芳香烃的合成路线| 浓硫酸 |
| 170℃ |
| Br2 |
 制备比
制备比 少2个氢原子的芳香烃苯乙炔,可先加成生成醇、再消去生成苯乙烯,再与溴水加成,最后发生消去反应.
少2个氢原子的芳香烃苯乙炔,可先加成生成醇、再消去生成苯乙烯,再与溴水加成,最后发生消去反应. ,故答案为:
,故答案为: ;
; +2Na2CO3→
+2Na2CO3→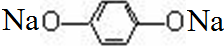 +2NaHCO3,
+2NaHCO3, +2Na2CO3→
+2Na2CO3→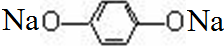 +2NaHCO3;
+2NaHCO3; 制备比
制备比 少2个氢原子的芳香烃苯乙炔,可先加成生成醇、再消去生成苯乙烯,再与溴水加成,最后发生消去反应,合成流程为
少2个氢原子的芳香烃苯乙炔,可先加成生成醇、再消去生成苯乙烯,再与溴水加成,最后发生消去反应,合成流程为 ,
, .
.


科目:高中化学 来源: 题型:
| ① |
| ④ |
| ② |
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学实验室需要0.2mol/L NaOH溶液500mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
某化学实验室需要0.2mol/L NaOH溶液500mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 4 |
| 化学键 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图装置中X和Y均为石墨电极,电解液为500mL某蓝色溶液,电解一段时间,观察到X电极表面有红色的固态物质生成,Y电极有无色气体生成;溶液中原有溶质完全电解后,停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6g.下列有关说法中不正确的是( )
如图装置中X和Y均为石墨电极,电解液为500mL某蓝色溶液,电解一段时间,观察到X电极表面有红色的固态物质生成,Y电极有无色气体生成;溶液中原有溶质完全电解后,停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6g.下列有关说法中不正确的是( )| A、X电极是阴极 |
| B、Y电极产生气体的体积为0.224L |
| C、电解后溶液的pH=1 |
| D、要使电解后溶液恢复到电解前的状态,需加入一定量的CuO或CuCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com