
长期存放在Na2SO3会被空气中的氧气部分氧化。某化学兴趣小组通过实验测不定期某无水Na2SO3被氧化的程度。
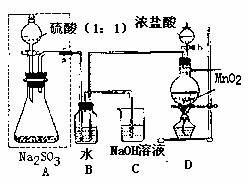
请回答:
(1)若将虚线框内的分液漏斗换成长颈漏斗,是应如何检查虚线框内装置的气密性?
。
(2)写出B装置中反应的离子方程式 。
(3)称量a g Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量BaC12溶液充分反应,过滤、洗涤、干燥、称量得白色沉淀b g,则样品中的Na2SO3的质量分数为 。
(4)深入研究发现,是述实验方案存在缺陷,致使测得的Na2SO3质量分数偏小,试分析其中的原因(列出一条即可) 。
(Ⅱ)乙同学设计了另一套实验装置如下图:
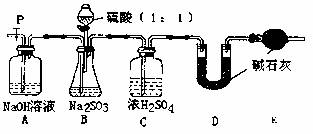
(5)实验中待锥形瓶中不再产生气体后,打开活塞P从导管左端缓缓鼓入一定量的空气,这样做的目的是 。
(6)除已称量的a g Na2SO4样品外,实验中还应测定的数据是 (填图中字母)装置实验前后的质量差。
(Ⅲ)现有以下试剂:蒸馏水、盐酸、稀硝酸、BaC12溶液、Ba(NO3)2溶液。
(7)丙同学欲从中选择合适试剂,来测定已知质量为a g的Na2SO3样品中Na2SO3的质量分数,下述实验方案理论上可行的有 。
A.将样品溶解,加足量盐酸,再加足量BaC12溶液,过滤、洗涤、干燥、称量沉淀m1g
B.将样品溶解,加足量盐酸,再加足量BaC12溶液,过滤、洗涤、干燥、称量沉淀m2g
C.将样品溶解,加过量BaC12溶液,过滤后,将虑液蒸干,称量得固体m3g
D.将样品溶液,加过量Ba(NO3)2溶液,过滤、洗涤,在沉淀中加入足量盐酸,再过滤、洗涤、干燥、称量得固体m4g
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014学年广东省惠州市高三第三次调研考试化学试卷(解析版) 题型:实验题
Na2SO3在空气中易被氧化而变质。某同学为证明Na2SO3有还原性,从一瓶实验室长期存放的Na2SO3固体中取出少量溶于水,滴入一定量的烧碱溶液和少许溴水,振荡后溶液变为无色。
(1)在碱性溶液中Br2和Na2SO3反应的离子方程式 。
(2)反应后的溶液含有SO32-、SO42-、Br-、OH-等阴离子,下表是某同学鉴定其中SO32-、SO42-和Br-的实验报告,请完成未填完的部分。
限选试剂:2 mol·L-1HCl;1 mol·L-1 H2SO4;l mol·L-1BaCl2;l mol·L-1Ba(NO3)2;1 mol·L-1 KMnO4、CCl4;新制饱和氯水;品红溶液。
|
编号 |
实验操作 |
预期现象和结论 |
|
步骤①
|
取少量待测液加入试管中,加入过量2mol·L-1HCl,再滴加适量1 mol·L-1BaCl2 溶液。 |
有白色沉淀生成,证明待测液中含有、SO42- 。 |
|
步骤②
|
|
|
|
步骤③
|
|
|
(3)为了测定上述样品的纯度,现取10.0克试样配成250ml溶液。取出25.00ml所配溶液,用0.10mol/L的酸性KMnO4溶液滴定至终点。反应离子方程式为:
重复操作三次,每次消耗0.10mol/L KMnO4溶液体积分别为20.02 ml、 20.00 ml和19.98 ml。(相对原子质量Na 23 S 32 O 16)
①计算样品中Na2SO3的质量分数为 。(结果保留3位有效数字)
②操作时,若未用0.10mol/L的酸性KMnO4溶液润洗滴定管,会导致测定结果 。(填“偏高”、“偏低”或“没有影响”)
查看答案和解析>>
科目:高中化学 来源:2010年浙江省高二第二学期期中考试(1-3班)化学试题 题型:填空题
(19分)高锰酸钾是锰的重要化合物和常用的氧化剂。以下是实验室中模拟工业上用软锰矿制备高锰酸钾的流程图。
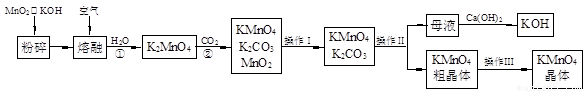
(1)操作Ⅰ的名称为 ;操作Ⅲ的名称为 。
(2)反应②的化学方程式为 。工业上用上述原理生产KMnO4方法产率较低,较好的制备方法是电解法。用Pt作阳极,Fe作阴极,K2MnO4为电解液,阳极的电极反应式为 。
(3)KMnO4是一种较稳定的化合物,但日光对KMnO4溶液的分解有催化作用,生成MnO2、KOH和O2。而 MnO2也是该分解反应的一种催化剂,请你设计一个实验方案,验证MnO2对该分解反应具有催化性: 。
(4)KMnO4在酸性介质中的强氧化性广泛应用于分析化学中。
例如:2KMnO4+3H2SO4+5Na2SO35Na2SO4+K2SO4+2MnSO4+3H2O。某同学用KMnO4测定实验室长期存放的Na2SO3固体的纯度。现欲准确称取6.3 g Na2SO3固体样品,配成500 mL溶液。取25.00 mL上述溶液放入锥形瓶中,用0.01000 mol/L 的酸性KMnO4溶液进行滴定。滴定结果如下表所示:
|
滴定次数[来源:][来源:Z&xx&k.Com] |
待测溶液的体积/mL[来源:学#科#网Z#X#X#K] |
标准溶液的体积[来源:] |
|
|
滴定前刻度/mL |
滴定后刻度/mL |
||
|
1 |
25.00 mL |
0.02 |
24.01 |
|
2 |
25.00 mL |
0.70 |
24.71 |
|
3 |
25.00 mL |
0.20 |
24.20 |
①配制500 mLNa2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、胶头滴管、药匙和 、 。
②判断滴定终点的依据是 。
③下列操作会导致测定结果偏高的是
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶未干燥
C.滴定前滴定管尖嘴部分有气泡
D.观察读数时,滴定前仰视,滴定后俯视
④用上述实验数据,计算Na2SO3的纯度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(14分)I 选择下列实验方法分离物质,将分离方法的序号依次为
①分离水和四氯化碳的混合物;②分离氯化钾溶液和沙子的混合物;
③从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
④ 分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)的混合物;
⑤分离食盐和碘的混合物; ⑥ 从碘水中提取碘单质。
A.过滤 B.结晶 C.分液 D.蒸馏 E.萃取分液 F.升华
II 、长期存放在Na2SO3会被空气中的氧气部分氧化。某化学兴趣小组通过实验测定某无水Na2SO3被氧化的程度。

请回答:(1)写出B装置中反应的离子方程式
(2)称量a g Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量BaC12溶液充分反应,过滤、洗涤、干燥、称量得白色沉淀b g,则样品中的Na2SO3的质量分数为 。
(3)深入研究发现,上述实验方案存在缺陷,致使测得的Na2SO3质量分数偏小,试分析其中的原因(列出一条即可) 。
(Ⅱ)乙同学设计了另一套实验装置如下图:

(4)实验中待锥形瓶中不再产生气体后,打开活塞P从导管左端缓缓鼓入一定量的空气,这样做的目的是 。
(5)除已称量的a g Na2SO3样品外,实验中还应测定的数据是 (填图中字母)装置实验前后的质量差。
(Ⅲ)现有以下试剂:蒸馏水、盐酸、稀硝酸、BaC12溶液、Ba(NO3)2溶液。
(6)丙同学欲从中选择合适试剂,来测定已知质量为a g的Na2SO3样品中Na2SO3的质量分数,下述实验方案理论上可行的有 。
A.将样品溶解,加足量盐酸,再加足量BaC12溶液,过滤、洗涤、干燥、称量沉淀m1g
B.将样品溶解,加足量盐酸,再加足量Ba(NO3)2溶液,过滤、洗涤、干燥、称量沉淀m2g
C.将样品溶解,加过量BaC12溶液,过滤后,将滤液蒸干,称量得固体m3g
D.将样品溶液,加过量Ba(NO3)2溶液,过滤、洗涤,在沉淀中加入足量盐酸,再过滤、洗涤、干燥、称量得固体m4g
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
长期存放的Na2SO3会被空气中的氧气部分氧化:某化学兴趣小组通过实验测定某无水Na2SO3被氧化的程度。
(Ⅰ)甲同学设计了下图实验
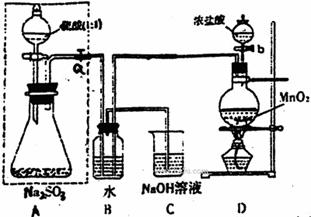
请回答:
(1)若将虚线框内的分液漏斗换成长颈漏斗,则应如何检查虚线框内装置的气密性?
。
(2)写出B装置中的离子方程式 。
写出D装置中反应的化学方程式 。
(3)称量agNa2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量BaCl2溶液
充分反应,过滤、洗涤、干燥、称量得白色沉淀bg,则样品中Na2SO3的质量分数为 。
(4)深入研究发现,上述实验方案存在缺陷,致使测得的Na2SO3质量分数偏小,试分析其中的原因(列出一条即可) 。
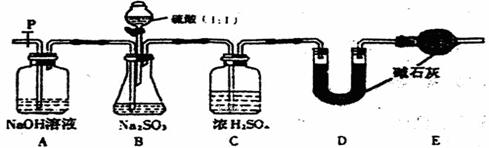 (Ⅱ)乙同学设计了另一套实验装置如下图:
(Ⅱ)乙同学设计了另一套实验装置如下图:
(5)实验中待锥形瓶中不再产生气体后,打开活塞P从导管左端缓缓鼓入一定量的空气,这样做的目的是 。
(6)除已称量的a g Na2SO3样品外,实验中还应测定的数据是 处,(填图中字母)装置实验前后的质量差。
(Ⅲ)现有以下试剂:蒸馏水、盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液。
丙同学欲从中选择合适试剂,来测定已知质量为a g的Na2SO3样品中Na2SO3的质
量分数。下述实验方案理论上可行的有 。
A.将样品溶解,加足量盐酸,再加足量BaCl2溶液,过滤、洗涤、干燥、称量得沉淀ml g
B.将样品溶解,加足量硝酸,再加足量BaCl2溶液、过滤、洗涤、干燥、称量得沉淀m2 g
C.将样品溶解,加过量BaCl2溶液,过滤后将溶液蒸干,称量得固体m3g
D.将样品溶解,加过量Ba(NO3)2溶液,过滤、洗涤,在沉淀中加入足量盐酸,再过滤,洗涤、干燥,称量得固体m4g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com