
(9分)某中学化学兴趣小组在课外活动时,对学校附近的甲、乙两条河流的 水质进行了多次检测。 第一组检测甲河流的水质结果如下:
|
检测次数 |
溶液中检测出的溶质 |
|
第一次 |
KCl K2SO4 Na2CO3 NaCl |
|
第二次 |
KCl BaCl2 Na2SO4 K2CO3 |
|
第三次 |
Na2SO4 KCl K2CO3 NaCl |
(1)三次检测结果中第 次的结果肯定不正确。
(2)在检测时,为了确定溶液中是否存在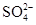 、CO32–和Cl–,该小组进行了如下实验,请你参与探究与分析。
、CO32–和Cl–,该小组进行了如下实验,请你参与探究与分析。
(3)第二组对乙河流进行检测,乙河流两边有甲、乙两工厂,经检测它们排放的工业废水中共含有K+、Ag+、Fe3+、、Cl–、OH–、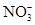 六种离子。并且甲厂的废水明显呈碱性,因此第二组断定甲厂废水中应含有的三种离子为 、 、 。
六种离子。并且甲厂的废水明显呈碱性,因此第二组断定甲厂废水中应含有的三种离子为 、 、 。
(1)二(2)①CO32– 2H++CO32-== H2O + CO2 ↑ ② Ba(NO3)2 ③AgNO3 Ag+
(3)OH- K+ Cl-
【解析】
试题分析:(1)由于Ba2+和SO42-不共存,所以二组一定是错误的。(2)向溶液中滴加过量的HNO3溶液,检验CO32-离子是否存在,反应的离子方程式为:2H++CO32-== H2O + CO2↑,检验SO42-离子的存在要加Ba(NO3)2,检验Cl-的存在要加入AgNO3。(3)因为甲厂的废水明显呈碱性,所以有OH-存在,不能与OH-共存的离子有Ag+、Fe3+,而与Ag+、Fe3+共存的离子有NO3-,这三种离子应该在乙厂废水中含有,所以甲厂排放的离子有OH- K+ Cl-。
考点:离子共存
点评:离子不能大量共存的一般情况是:(1)能发生复分解反应的离子之间(即生成沉淀,气体,水、弱酸、弱碱等难电离物质);(2)能生成难溶物的离子之间(如:Ca2+和 SO42-;Ag+和 SO42-);(3)能完全水解的离子之间,如多元弱酸和弱碱盐的阴、阳离子(如:Al3+, Fe3+与 CO32-、HCO3-、AlO2-、ClO-,S2-等);(4)能发生氧化还原反应的离子之间(如:Fe 、H+、NO3-;S2-、ClO-;S2-、 Fe3+等);(5)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
| 检测次数 | 溶液中检测出的溶质 |
| 第一次 | KCl、K2SO4、Na2CO3、NaCl |
| 第二次 | KCl、BaCl2、Na2SO4、K2CO3 |
| 第三次 | Na2SO4、KCl、K2CO3、NaCl |
| O | 2- 4 |
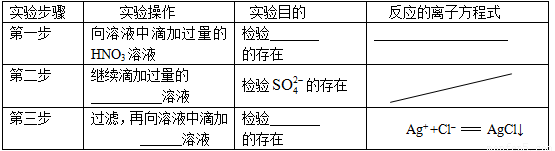
| 实验步骤 | 实验操作 | 实验目的 | 反应的离子方程式 | ||
| 第一步 | 向溶液中滴加过量的HNO3溶液 | 检验 CO32- CO32- 的存在 |
2H++CO32-═CO2↑+H2O 2H++CO32-═CO2↑+H2O | ||
| 第二步 | 继续滴加过量的 Ba(NO3)2 Ba(NO3)2 溶液 |
检验S
|
|||
| 第三步 | 过滤,再向溶液中滴加 AgNO3 AgNO3 溶液 |
检验 Cl- Cl- 的存在 |
Ag++Cl-═AgCl↓ |
| O | - 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
氨有着广泛的用途,如可用于化肥、硝酸、合成纤维等工业生产。氨的水溶液中存在电离平衡,常用电离常数Kb和电离度α来定量表示其电离程度。Kb和α常用的测定方法:在一定温度时用酸度计测定一系列已知浓度氨水的pH,可得各浓度氨水对应的c(OH-),然后通过换算求得各对应的α值和Kb值。下面是某中学化学兴趣小组在25℃时测定一系列浓度氨水的pH所对应的c(OH-):
【仪器与试剂】酸度计、50 mL碱式滴定管、100mL烧杯、 0.10 mol·L-1 氨水
【实验数据】(不必填表格)
| 烧杯号 | V氨水 (mL) | V水(mL) | c (NH3·H2O) (mol·L-1) | c(OH-) | Kb | α |
| 1 | 50.00 | 0.00 |
| 1.34×10-3 |
|
|
| 2 | 25.00 | 25.00 |
| 9.48×10-4 |
|
|
| 3 | 5.00 | 45.00 |
| 4.24×10-4 |
|
|
请根据以上信息回答下述问题:
(1)25℃时,氨水的电离常数:Kb![]() ▲ ,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系 ▲ 。
▲ ,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系 ▲ 。
(2)用0.10mol·L—1盐酸分别滴定20.00mL0.10mol·L—1的NaOH溶液和20.00mL0.10mol·L—1
氨水所得的滴定曲线如下:
请指出盐酸滴定氨水的曲线为 ▲ (填A或B),请写出曲线a点所对应的溶液中各离子浓度由大到小的排列顺序 ▲ 。
(3)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧试验机中相关的反应有:
4NH3(g)+3O2(g)= 2N2(g)+6H2O(l) △H1 ①
4NH3(g)+5O2(g)= 4NO(g)+6H2O(l) △H2 ②
4NH3(g)+6NO(g)= 5N2(g)+6H2O(l) △H3 ③
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= ▲ 。
(4)Allis-Chalmers制造公司发现可以用氨作为燃料电池的燃料。其总反应式为4NH3+3O2=2N2+6H2O,正极上的电极反应式为O2+2H2O+4e—=4OH—,则负极上的电极反应式为 ▲ 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年浙江省台州市高三调考试题(理综)化学部分 题型:填空题
氨有着广泛的用途,如可用于化肥、硝酸、合成纤维等工业生产。氨的水溶液中存在电离平衡,常用电离常数Kb和电离度α来定量表示其电离程度。Kb和α常用的测定方法:在一定温度时用酸度计测定一系列已知浓度氨水的pH,可得各浓度氨水对应的c(OH-),然后通过换算求得各对应的α值和Kb值。下面是某中学化学兴趣小组在25℃时测定一系列浓度氨水的pH所对应的c(OH-):
【仪器与试剂】酸度计、50 mL碱式滴定管、100mL烧杯、 0.10 mol·L-1 氨水
【实验数据】(不必填表格)
|
烧杯号 |
V氨水 (mL) |
V水(mL) |
c (NH3·H2O) (mol·L-1) |
c(OH-) |
Kb |
α |
|
1 |
50.00 |
0.00 |
|
1.34×10-3 |
|
|
|
2 |
25.00 |
25.00 |
|
9.48×10-4 |
|
|
|
3 |
5.00 |
45.00 |
|
4.24×10-4 |
|
|
请根据以上信息回答下述问题:
(1)25℃时,氨水的电离常数:Kb ▲ ,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系
▲ 。
▲ ,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系
▲ 。
(2)用0.10mol·L—1盐酸分别滴定20.00mL0.10mol·L—1的NaOH溶液和20.00mL0.10mol·L—1
氨水所得的滴定曲线如下:
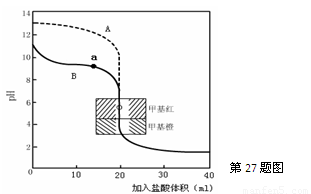
请指出盐酸滴定氨水的曲线为 ▲ (填A或B),请写出曲线a点所对应的溶液中各离子浓度由大到小的排列顺序 ▲ 。
(3)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧试验机中相关的反应有:
4NH3(g)+3O2(g)= 2N2(g)+6H2O(l) △H1 ①
4NH3(g)+5O2(g)= 4NO(g)+6H2O(l) △H2 ②
4NH3(g)+6NO(g)= 5N2(g)+6H2O(l) △H3 ③
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= ▲ 。
(4)Allis-Chalmers制造公司发现可以用氨作为燃料电池的燃料。其总反应式为4NH3+3O2= 2N2+6H2O,正极上的电极反应式为O2+2H2O+4e—=4OH—,则负极上的电极反应式为 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com