
镁、铝合金3g与100mL稀H2SO4恰好完全反应,将反应后所得溶液蒸干,得无水硫酸盐17.4g,求算原硫酸溶液的物质的量浓度?
考点: 化学方程式的有关计算.
分析: 镁、铝合金3g与100mL稀H2SO4恰好完全反应,将反应后所得溶液蒸干,得无水硫酸盐17.4g为硫酸镁和硫酸铝的质量,根据镁、铝质量守恒计算硫酸根的质量,再计算出硫酸根的物质的量,利用硫酸根守恒计算溶质硫酸的物质的量,以此计算硫酸的物质的量浓度.
解答: 解:17.4g为硫酸镁和硫酸铝的质量,
由于镁、铝合金3g,所以17.4g中硫酸根的质量为17.4g﹣3g=14.4g,
所以硫酸根的物质的量为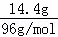 =0.15mol,
=0.15mol,
所以100mL稀H2SO4含有溶质硫酸的物质的量为0.15mol,
所以该稀硫酸的浓度为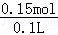 =1.5mol/L,
=1.5mol/L,
答:原硫酸溶液的物质的量浓度为1.5 mol/L.
点评: 本题考查物质的量浓度及反应的计算,为高频考点,侧重学生分析能力及计算能力的考查,本解法采取守恒法计算硫酸根的质量及硫酸的物质的量可简化计算,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
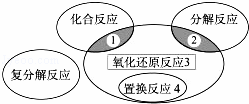
氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于区域3的是()
A. 2H2+O2 2H2O
2H2O
B. 2NaHCO3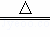 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C. CuO+CO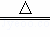 Cu+CO2
Cu+CO2
D. Zn+H2SO4=ZnSO4+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
根据以下反应判断:Fe3+、Fe2+、Cu2+的氧化性强弱顺序是()
①Fe+CuCl2=Cu+FeCl2
②2FeCl3+Cu=CuCl2+2FeCl2.
A. Fe2+>Cu2+>Fe3+ B. Fe3+>Fe2+>Cu2+
C. Fe3+>Cu2+>Fe2+ D. Cu2+>Fe2+>Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中,溶质的物质的量浓度为1mol/L的是()
A. 将40 g NaOH溶于1 L 水所得的溶液
B. K+为0.5 mol的K2SO4溶液
C. 将0.5 mol/L的NaNO3溶液100 mL 加热蒸发掉50 g水所得的溶液
D. 含0.2molNO3﹣的Cu(NO3)2溶液100mL
查看答案和解析>>
科目:高中化学 来源: 题型:
已知98%的浓硫酸的物质的量浓度为18.4mol/L,则49%的硫酸的物质的量浓度()
A. 等于9.2 mo1/L B. 小于 9.2 mo1/L
C. 大于 9.2 mo1/L D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作均要用玻璃棒,其中玻璃棒用作引流的是()
①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体.
A. ①和② B. ①和③ C. ③和④ D. ①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
在配制一定物质的量浓度的NaOH溶液时,下列哪个原因会造成所配溶液浓度偏高()
A. 所用NaOH已经潮解
B. 向容量瓶中加水未到刻度线
C. 有少量NaOH溶液残留在烧杯里
D. 定容时观察液面仰视
查看答案和解析>>
科目:高中化学 来源: 题型:
从降低成本和减少环境污染的角度考虑,制取硝酸铜最好的方法是()
A. 铜和浓硝酸反应 B. 铜和稀硝酸反应
C. 氧化铜和硝酸反应 D. 氯化铜和硝酸银反应
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y两元素的质子数之和为22,X的原子核外电子数比Y少6个,下列说法中不正确的是( )
|
| A. | Y的单质是金属晶体 |
|
| B. | X的单质固态时为分子晶体 |
|
| C. | X与碳形成的化合物为分子晶体 |
|
| D. | X与Y形成的化合物固态时为分子晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com