
. 下图所示装置中,甲、乙、丙三个烧杯依次分别盛放NaOH溶液、CuSO4溶液和K2SO4溶液,电极均为石墨电极。
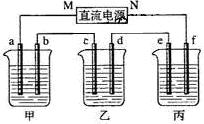
接通电源,经过一段时间后,测得乙中c电极质量增加了16g。据此回答下列问题:
(1)电极b上发生的电极反应为 ;
(2)计算电极e上生成的气体在标准状态下的体积: ;
(3)电解后甲溶液的pH (填“增大”、“减小”或“不变”) ,简述其原因: ;
(4)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
。
(1)4OH--4e-=2H2O + O2↑(2分)
(2)5.6 L (2分)
(3)增大(1分)因为相当于电解水(1分)
(4)能,因为CuSO4溶液已转变为H2SO4溶液,反应变为电解水的反应(2分)
(1)乙中c电极质量增加,则c处发生的反应为:Cu2++2e-=Cu,即c处为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极。甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-=2H2O + O2↑。
(2)当乙中有16gCu析出时,转移的电子为0.5mol。而整个电路是串联的,故每个烧杯中的电极上转移电子数是相等的。丙中为K2SO4,相当于电解水,由方程式2H2O ![]() 2H2↑+O2↑可知,生成2molH2,转移4mol电子,所以当整个反应中转移0.5mol电子时,生成的H2为0.25mol,标况下的体积为0.25mol×22.4L/mol=5.6L。
2H2↑+O2↑可知,生成2molH2,转移4mol电子,所以当整个反应中转移0.5mol电子时,生成的H2为0.25mol,标况下的体积为0.25mol×22.4L/mol=5.6L。
(3)甲中相当于电解水,故NaOH的浓度增大,pH变大。
(4)铜全部析出后,电解质变为H2SO4,所以电解反应仍能进行。


科目:高中化学 来源: 题型:阅读理解
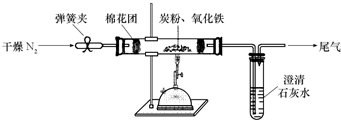
| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
 下图所示装置中观察到电流计指针偏转,M棒有气泡,N棒变细,由此判断下表中所列M、N、P物质,其中正确的组合是( ) 下图所示装置中观察到电流计指针偏转,M棒有气泡,N棒变细,由此判断下表中所列M、N、P物质,其中正确的组合是( )
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com