
常温下,下列各组离子在指定溶液中一定能大量共存的是

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015届北京市高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
下列各组在溶液中的反应,无论反应物的量多少,都能用同一离子方程式表示的是
A.Ba(OH)2与H2SO4 B.FeBr2与Cl2
C.HCl与Na2CO3 D.NaHCO3与Ca(OH)2
查看答案和解析>>
科目:高中化学 来源:2015届北京市朝阳区高三年级第一学期期中统一考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列说法不正确的是
A.标准状况下,22.4 L O2含有的分子数为NA
B.常温常压下,3.4 g H2O2含有极性键的数目为0.2 NA
C.将含Na+数目为NA的NaCl固体溶于1 L水中,所得溶液的浓度为1 mol·L-1
D.标准状况下,2.24 L Cl2与足量NaOH溶液反应,转移电子的数目为0.1 NA
查看答案和解析>>
科目:高中化学 来源:2015届北京十中高三第一学期期中化学试卷(解析版) 题型:填空题
(本小题14分)氮气是制备含氮化合物的一种重要物质,而含氮化合物的用途广泛。
(1)图中表示两个常见的固氮反应:
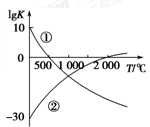
①N2+3H2 2NH3
2NH3
②N2+O2 2NO的平衡常数(lg K)与温度的关系,
2NO的平衡常数(lg K)与温度的关系,
根据图中的数据判断下列说法正确的是________(填序号)。
A.反应②为放热反应
B.常温下,反应①的反应速率很大,而反应②的反应速率很小
C.升高温度,反应①的反应速率增大,反应②的反应速率减小
D.在常温下,利用反应①固氮和利用反应②固氮反应程度相差很大
(2)工业上也可在碱性溶液中通过电解的方法实现由N2制取NH3:2N2+6H2O 4NH3+3O2,通入N2的一极是________(填“阴极”或“阳极”),阳极的电极反应式是____ ____。
4NH3+3O2,通入N2的一极是________(填“阴极”或“阳极”),阳极的电极反应式是____ ____。
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应:
①N2(g)+3H2O(l) 2NH3(g)+
2NH3(g)+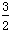 O2(g) ΔH=a kJ/mol。
O2(g) ΔH=a kJ/mol。
已知:②N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ/mol,
2NH3(g) ΔH=-92.4 kJ/mol,
2H2(g)+O2(g) 2H2O(l) ΔH=-571.6 kJ/mol,则a=__________。
2H2O(l) ΔH=-571.6 kJ/mol,则a=__________。
(4)已知:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH=-1316 kJ·mol-1 ,氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。
2N2(g)+6H2O(g) ΔH=-1316 kJ·mol-1 ,氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。
①当温度不同(T2>T1)、其他条件相同时,下列图像正确的是________(填代号)。
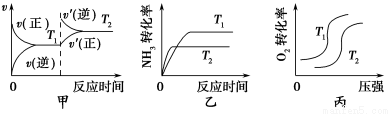
②该燃料电池的负极反应式是____________________________________。
(5)工业上合成氨时,温度过高,氨气的产率降低,试从化学平衡移动原理的角度加以解释:__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届北京十中高三第一学期期中化学试卷(解析版) 题型:选择题
已知:2H2(g) +O2(g) = 2H2O(g) ΔH =-483.6 kJ/mol
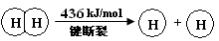

下列说法不正确的是
A.H2(g) 中的H—H 键比 H2O(g) 中的H—O 键牢固
B.H2O(g)=H2(g) + 1/2O2(g) ΔH = +241.8 kJ/mol
C.破坏1 mol H—O 键需要的能量是463.4 kJ
D.H2(g) + 1/2O2(g)=H2O(l) ΔH <-241.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古赤峰市高三上学期9月质量检测化学试卷(解析版) 题型:填空题
(15分)(物质结构与性质)金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)Ti基态原子的电子排布式为: 。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。电负性:C (填“>”或“<”,下同)B;第一电离能:N O 。
(3)月球岩石——玄武岩的主要成分为钛硫酸亚铁 与80%的硫酸反应可生成
与80%的硫酸反应可生成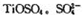 的空间构型为 形,其中硫原子采用 杂化。
的空间构型为 形,其中硫原子采用 杂化。
(4)磷酸肽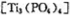 锂离子电池能来那个密度大、安全性高。
锂离子电池能来那个密度大、安全性高。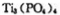 可由
可由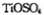 与
与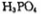 反应制得。两分子
反应制得。两分子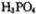 发生脱水生成焦磷酸:
发生脱水生成焦磷酸:
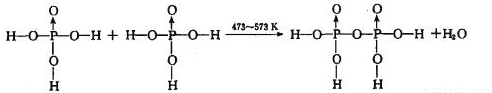
则三分子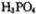 脱去两分子
脱去两分子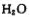 生成三磷酸,其结构式为 ,四分子
生成三磷酸,其结构式为 ,四分子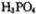 脱去四分子
脱去四分子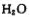 生成的四偏磷酸属于 元酸。
生成的四偏磷酸属于 元酸。
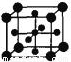
(5)Ti的氧化物和CaO相互作用能形成太酸盐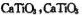 的晶体结构如图所示(Ti位于立方体的顶点)。该晶体中Ti4+和周围 个O2-紧邻。
的晶体结构如图所示(Ti位于立方体的顶点)。该晶体中Ti4+和周围 个O2-紧邻。
(6)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中
实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重
大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为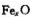 (x<1),若测得某
(x<1),若测得某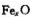 晶体密度为5.71g·cm-3,晶胞边长为4.28×
晶体密度为5.71g·cm-3,晶胞边长为4.28×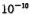 m,则
m,则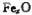 中x= 。
中x= 。
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古赤峰市高三上学期9月质量检测化学试卷(解析版) 题型:选择题
某工厂用硫酸处理氨气尾气,得到铵盐(不同批次得到a、b、c三种不同的铵盐)。称取不同质量的铵盐,加入到固定量的NaOH溶液中并加热,收集氨气,得到如下生成氨气的量与加入铵盐的量的关系图:
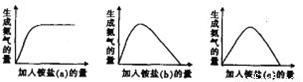
下列判断不正确的是:
A.a对应的铵盐是(NH4)2SO4
B. b对应的铵盐是(NH4)2SO4和NH4HSO4
C.c对应的铵盐是NH4HSO4
D.当b和c铵盐的质量相同时,可得到相同质量的氨气
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古赤峰市宁城县高三上学期摸底统一考试化学试卷(解析版) 题型:实验题
(15分)某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体,以证明+6价S的氧化性强于+1价H。
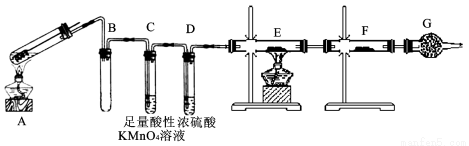
(1)填写装置的作用: B , C ,G 。
(2)证明有SO2生成的现象是
(3)可以证明气体X中含有氢气的实验现象是:E中:__________________,F中:__________________。如果去掉装置D,还能否根据F中的现象判断气体中有氢气?________(填“能”或 “不能”),原因是______
。
(4)反应后A的溶液中含有Fe3+和Fe2+,检验其中的Fe2+的方法是 。
(5)若将铁丝换成铜丝,反应后的溶液没有出现预计的蓝色溶液,而出现了大量白色固体,原因是 ,要确认CuSO4生成,待试管冷却后, 。
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古巴彦淖尔市高三10月月考化学试卷(解析版) 题型:选择题
下列溶液中:①石灰水 ②Na2S溶液 ③KMnO4溶液 ④溴水
⑤酸化的Ba(NO3)2溶液 ⑥品红溶液,不能区别SO2和CO2气体的是
A.②④⑤ B.①② C.①②⑤ D.只有①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com