
| A. | 简单阳离子半径:X<R | B. | 最高价含氧酸的酸性:Z<Y | ||
| C. | M的氢化物常温常压下为气体 | D. | X与Y可以形成正四面体结构的分子 |
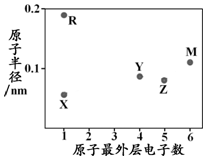
分析 X、Y、Z、M、R为五种短周期元素,X、R最外层只有一个电子,为第IA族元素;Y最外层有4个电子,位于第IVA族,Z原子最外层有5个电子,位于第VA族,M最外层有6个电子,位于第VIA族;
R原子半径最大,为Na元素,X原子半径最小,为H元素;Y原子和Z原子半径接近、M原子半径大于Y而最外层电子数大于Y,所以Y是C、Z是N、M为S元素;
A.离子电子层数越多其离子半径越大;
B.元素的非金属性越强,其最高价含氧酸的酸性越强;
C.M的氢化物的硫化氢;
D.X、Y可以形成CH4.
解答 解:X、Y、Z、M、R为五种短周期元素,X、R最外层只有一个电子,为第IA族元素;Y最外层有4个电子,位于第IVA族,Z原子最外层有5个电子,位于第VA族,M最外层有6个电子,位于第VIA族;
R原子半径最大,为Na元素,X原子半径最小,为H元素;Y原子和Z原子半径接近、M原子半径大于Y而最外层电子数大于Y,所以Y是C、Z是N、M为S元素;
A.离子电子层数越多其离子半径越大,所以离子半径R>X,故A正确;
B.元素的非金属性越强,其最高价含氧酸的酸性越强,非金属性Z>Y,所以其最高价含氧酸酸性Z>Y,故B错误;
C.M的氢化物的硫化氢,常温下为气体,故C正确;
D.X、Y可以形成CH4,甲烷为正四面体结构,故D正确;
故选B.
点评 本题考查原子结构和元素周期律,侧重考查学生推断及知识综合运用、灵活运用能力,明确离子半径比较方法、最高价含氧酸比较方法、物质结构是解本题关键,注意规律中的反常现象,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 滴定管未用标准酸液或标准碱液润洗 | |
| B. | 锥形瓶用待测液润洗后加入待测液 | |
| C. | 滴定管在滴定前未进行赶气 | |
| D. | 读数时视线要平视 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,E池中加入0.1mol/L CuCl2 溶液,F池中加入0.1mol/L AgNO3 溶液,将四个铂电极串联起来通电,则a,b,c,d 四电极上所产生的物质,其物质的量之比为( )
如图所示,E池中加入0.1mol/L CuCl2 溶液,F池中加入0.1mol/L AgNO3 溶液,将四个铂电极串联起来通电,则a,b,c,d 四电极上所产生的物质,其物质的量之比为( )| A. | 2:2:4:1 | B. | 1:1:2:1 | C. | 2:1:l:1 | D. | 2:2:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 虽然Cu能导电,但Cu是非电解质 | |
| B. | AgCl虽然难溶于水,但AgCl是电解质 | |
| C. | SO3、NH3的水溶液均能导电,所以SO3、NH3均是电解质 | |
| D. | KNO3溶液能导电,所以硝酸钾溶液是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、HCO3-、Cl- | B. | K+、NH4+、Cl-、SO42- | ||
| C. | K+、Cu2+、SO42、Cl- | D. | Mg2+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成0.025 mol P2O5 | |
| B. | 生成 P2O3所释放的热量为(Y-0.05X) kJ | |
| C. | 2P(s)+$\frac{3}{2}$O2(g)=P2O3(s)△H=-(40Y-2X)kJ•mol-1 | |
| D. | 生成的 P2O3与 P2O5的质量之比为 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
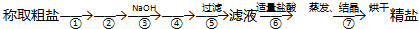
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
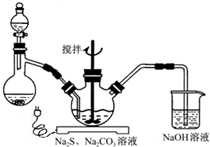 NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题:
NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题: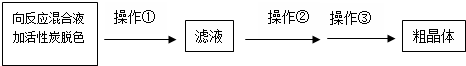
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com