
钨是我国丰产元素。自然界中钨主要以钨(+6)酸盐的形式存在。黑钨矿的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4)。黑钨矿传统冶炼工艺流程图如下:
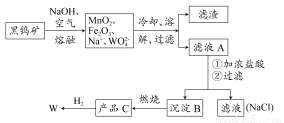
(1)已知上述转化中,除最后一步外,W的化合价未发生变化,则产品C的化学式为 ;如何将其冶炼成单质(用化学方程式表示): 。
根据金属的活动性不同,金属的冶炼方法一般有 三种。
(2)写出第一步转化中“Mn2+→MnO2”的离子方程式 。
(3)我国钨化学研究的奠基人顾翼东先生采用另外的反应制得了一种蓝色的、非整比的钨的氧化物WO(3-x)。这种蓝色氧化钨具有比表面大、易还原的优点。一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在正五价和正六价两种价态的钨,已知x的值为0.1,则蓝色氧化钨中这两种价态的钨原子数之比为 。
科目:高中化学 来源:2014年高考化学苏教版总复习 3-3 含硅矿物与信息材料练习卷(解析版) 题型:选择题
下列说法不正确的是( )
A.人造纤维、合成纤维和光导纤维都是有机高分子化合物
B.太阳能电池可利用硅材料制作,其应用有利于节能环保
C.“冰,水为之,而寒于水”,说明相同质量的水和冰,水的能量高
D.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后再用酸溶解除去
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 2-2 钠、镁及其化合物练习卷(解析版) 题型:选择题
下列各组物质中,不能按 (“→”表示一步转化)关系相互转化的是( )
(“→”表示一步转化)关系相互转化的是( )
选项abc
AH2OO2Fe(OH)3
BNaNa2ONaCl
CCNO2HNO3
DFeCl2FeFeCl3
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 2-1 氯、溴、碘及其化合物练习卷(解析版) 题型:选择题
下列是卤素单质(F2、Cl2、Br2、I2)的沸点与相对分子质量的关系图,下列说法错误的是( )

A.单质①是最活泼的非金属单质
B.单质②能使品红溶液褪色
C.单质③在常温下是液态
D.单质的氧化性强弱顺序是④>③>②>①
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 2-1 氯、溴、碘及其化合物练习卷(解析版) 题型:选择题
下列叙述正确的是( )
A.液溴易挥发,在存放液溴的试剂瓶中应加水封
B.能使湿润的淀粉KI试纸变蓝色的物质一定是Cl2
C.某溶液中加入CCl4,CCl4层显紫色,证明原溶液中存在I-
D.某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 13-2 化学资源与材料练习卷(解析版) 题型:选择题
下列关于工业生产说法错误的是( )
A.在侯氏制碱工业中,向饱和氯化钠溶液中先通入氨气,后通入二氧化碳
B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率
C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室
D.工业上采用电解熔融氯化铝的方法制取金属铝
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 13-2 化学资源与材料练习卷(解析版) 题型:选择题
化学在生产和日常生活中有着重要的应用。下列说法不正确的是( )
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.高温水解Al2O3可制得金属铝
C.MgO的熔点很高,可用于制作耐高温材料
D.根据冷的浓硫酸可以用铝质容器储存的事实,说明常温下铝不会与浓硫酸发生反应
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 12-3 分子空间结构与物质性质练习卷(解析版) 题型:填空题
(1)图1为元素X的前五级电离能的数值示意图。已知X的原子序数<20,请写出X基态原子的核外电子排布式 。
(2)A、B、C、D、E、F、G、H八种短周期元素,其单质的沸点如图2所示。
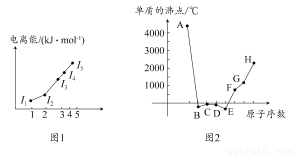
请回答:
①上述元素中,某些元素的常见单质所形成的晶体为分子晶体,这些单质分子中既含有σ键又含有π键的是 (填化学式)。
②已知D、F、G三种元素的离子具有跟E相同的电子层结构,则B、C、D三种元素的第一电离能由大到小的顺序为(用相关元素符号表示) 。
③已知H的电负性为1.5,而氯元素的电负性为3.0,二者形成的化合物极易水解,且易升华。据此推测该化合物的化学键类型为 。
④原子序数比A小1的元素与D元素形成的化合物的空间构型为 ,中心原子的杂化方式为 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 12-1 原子结构与元素的性质练习卷(解析版) 题型:选择题
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为( )
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强
D.以上说法都不正确
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com