
分析 (1)Fe与盐酸反应,而Cu不能;
(2)HCl与饱和碳酸氢钠反应生成二氧化碳;
(3)氧化铝与NaOH反应,而MgO不能;
(4)二氧化碳与NaOH反应,而氧气不能;
(5)碳酸钠与二氧化碳、水反应生成碳酸氢钠.
解答 解:(1)Fe与盐酸反应,而Cu不能,离子反应为Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(2)HCl与饱和碳酸氢钠反应生成二氧化碳,离子反应为H++HCO3-=H2O+CO2↑,故答案为:H++HCO3-=H2O+CO2↑;
(3)氧化铝与NaOH反应,而MgO不能,离子反应为Al2O3+2OH-═2AlO2-+H2O,故答案为:Al2O3+2OH-═2AlO2-+H2O;
(4)二氧化碳与NaOH反应,而氧气不能,离子反应为CO2+2OH-═CO32-+H2O,故答案为:CO2+2OH-═CO32-+H2O;
(5)碳酸钠与二氧化碳、水反应生成碳酸氢钠,离子反应为CO2+CO32-+H2O=2HCO3-,故答案为:CO2+CO32-+H2O=2HCO3-.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力及混合物分离提纯考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
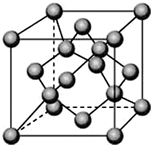 已知A、B、C、D都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他3种元素既不在同一周期又不在同一主族.B原子的L层p轨道中有5个电子;C是周期表中1-18列中的第14列元素;D原子的L层电子数与最外层电子数之比为4:1,其d轨道中有一对成对电子.请回答:
已知A、B、C、D都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他3种元素既不在同一周期又不在同一主族.B原子的L层p轨道中有5个电子;C是周期表中1-18列中的第14列元素;D原子的L层电子数与最外层电子数之比为4:1,其d轨道中有一对成对电子.请回答: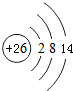 ,它的+3价离子的电子排布式为1s22s22p63s2sp5.
,它的+3价离子的电子排布式为1s22s22p63s2sp5.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 实验室里要配制465mL 0.2mol/L的硫酸钠溶液.
实验室里要配制465mL 0.2mol/L的硫酸钠溶液.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
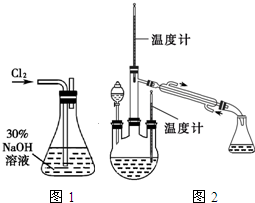 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL | B. | 200 mL | C. | 300 mL | D. | 400 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 | |
| B. | 石油裂解、煤的气化、海水制镁等过程中都包含化学变化 | |
| C. | 煤经气化、液化和干馏三个物理变化过程,可变为清洁能源 | |
| D. | 通过化学变化可以实现235U与238U的相互转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com