

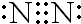 ,故答案为:
,故答案为: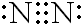 ;
; mol,反应⑥的离子方程式是2Al+6H2O+2OH-=2[Al(OH)4]-+3H2↑,
mol,反应⑥的离子方程式是2Al+6H2O+2OH-=2[Al(OH)4]-+3H2↑, mol;2Al+6H2O+2OH-=2[Al(OH)4]-+3H2↑.
mol;2Al+6H2O+2OH-=2[Al(OH)4]-+3H2↑.

科目:高中化学 来源: 题型:











查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-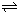 C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.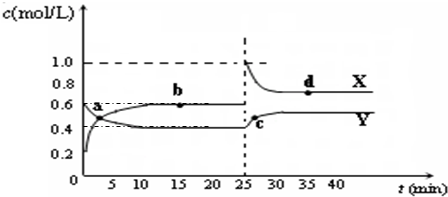
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | 单质在自然界中硬度最大 |
| B | 原子中s能级与p能级电子数相等且有单电子 |
| C | C同在B的下一周期,C的电离能数据(kJ?mol-1)为:I1=738 I2=1451 I3=7732 I4=10540 |
| D | 单质密度小,较好的延展性,广泛用于食品包装,D的氧化物是两性氧化物 |
| E | 单质是一种常见金属,与O元素能形成黑色和砖红色两种氧化物 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省八市高三三月联考理综化学试卷(解析版) 题型:填空题
Ⅰ.铬位于第四周期ⅥB族,主要化合价+2,+3 ,+6,单质硬度大,耐腐蚀,是重要的合金材料。
(1)基态铬原子的价电子排布图___________,CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是________(填“极性”或“非极性”)分子。
(2)CrCl3·6H2O实际上是配合物,配位数为6,其固体有三种颜色,其中一种浅绿色固体与足量硝酸银反应时,1mol固体可生成2mol氯化银沉淀,则这种浅绿色固体中阳离子的化学式____________。
Ⅱ.砷化镓为第三代半导体材料,晶胞结构如图所示,
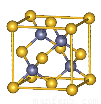
(3)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的化学方程式???? 为??????????? 。??
(4)AsH3空间构型为 ??????????????????? 。
已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式是_______。
(5)砷化镓晶体中最近的砷和镓原子核间距为a cm,砷化镓的摩尔质量为b g/mol,阿伏伽德罗常数值为NA,则砷化镓晶体密度的表达式_________ g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com