
�ֽ�2mol����A��1mol����B����һ�������ܱ������ڣ�������Ӧ��2A+B![]() C+3D+4E���ﵽƽ�������A��Ũ�ȼ���һ�룬����������Һ�����ɣ�����ͬ���¶��²�÷�Ӧǰ��ѹǿ�ֱ�Ϊ6.06��106��8.08��106Pa���ֲ�÷�Ӧ���ų�����Q kJ������˵����ȷ����( )
C+3D+4E���ﵽƽ�������A��Ũ�ȼ���һ�룬����������Һ�����ɣ�����ͬ���¶��²�÷�Ӧǰ��ѹǿ�ֱ�Ϊ6.06��106��8.08��106Pa���ֲ�÷�Ӧ���ų�����Q kJ������˵����ȷ����( )
![]() A.������Ӧ�ﵽƽ��� �������������������£�ֻ�ı�ѹǿ��ƽ�ⲻ�ƶ�
A.������Ӧ�ﵽƽ��� �������������������£�ֻ�ı�ѹǿ��ƽ�ⲻ�ƶ�
![]()
![]()
![]() B.�÷�Ӧ�Ļ�ѧƽ�ⳣ��ΪK=
B.�÷�Ӧ�Ļ�ѧƽ�ⳣ��ΪK=
![]()
![]() C.E����
C.E����
![]() D.�÷�Ӧ���Ȼ�ѧ����ʽ 2A(g) +B(g)��C(g) + 3D(l) + 4E(g) ��H����QkJ/mol
D.�÷�Ӧ���Ȼ�ѧ����ʽ 2A(g) +B(g)��C(g) + 3D(l) + 4E(g) ��H����QkJ/mol
![]()
![]()

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| CO2ת���ʣ�%�� n��H2��/n��CO2�� |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
| c(CH3OH)?c(H2O) |
| c3(H2)?c(CO2) |
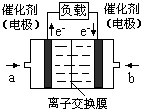 ����������b���缫�Ϸ����ĵ缫��Ӧ�ǣ�
����������b���缫�Ϸ����ĵ缫��Ӧ�ǣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��1����ʵ֤��������Ƴ�ԭ��صķ�Ӧͨ���Ƿ��ȷ�Ӧ�����л�ѧ��Ӧ�������Ͽ�����Ƴ�ԭ��ص���
��1����ʵ֤��������Ƴ�ԭ��صķ�Ӧͨ���Ƿ��ȷ�Ӧ�����л�ѧ��Ӧ�������Ͽ�����Ƴ�ԭ��ص���
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ�����¶��£��п��淴Ӧ��2A(g) + 2B(g)![]() C(g) + 2D(g) �ֽ�2mol A ��2mol B�������Ϊ�ֵļ������У�2mol C��4mol D�������Ϊ2�ֵ��������С�����˵����ȷ����
C(g) + 2D(g) �ֽ�2mol A ��2mol B�������Ϊ�ֵļ������У�2mol C��4mol D�������Ϊ2�ֵ��������С�����˵����ȷ����
������ʼ��Ӧʱ��������������Ӧ�������ҷ�Ӧ������Ӧ������ͬ
�£����ﵽƽ���Ӧ�����������Ǽ�������2��
�ã����ﵽƽ���������ƽ����Է��������������Ǽ�������2��
D�����ﵽƽ���������������2molA��2molB���ﵽ�µ�ƽ��õ�����������������ڼ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com