
近年来,由于温室效应和资源短缺等问题,关于CO2和碳酸盐应用的研究受到人们的重视。某研究小组利用反应:CO(g)+H2O(g) H2(g)+CO2(g)
△H=-41.2kJ/mol ,制备CO2与H2 的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
H2(g)+CO2(g)
△H=-41.2kJ/mol ,制备CO2与H2 的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
(1) 已知:850℃时在一体积为10 L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图1所示:

下列说法正确的是 (填序号)
A.达到平衡时,氢气的物质的量是0.12mol
B.达到平衡时,反应体系最终会放出49.44kJ热量
C.在0—4min,混合气体的平均相对分子质量增大
D.第6min时,若升高温度,反应平衡常数会减小
E.第8min时,若充入氦气,会导致v正(CO)<v逆(H2O)
(2) 850 ℃时,若在容积为2 L的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2。若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
(3) 如将H2 与CO2以4:1的体积比混合,在适当的条件下可制得CH4。已知:
CH4 (g)+2O2(g)=CO2(g)+ 2H2O(l) ΔH1=-890.3 kJ/mol
H2(g)+1/2O2(g)=H2O(l) ΔH2=-285.8 kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是 。
(4) 熔融盐燃料电池(见图2)是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是CH4 +4CO32--8e-=5CO2+2H2O。正极的电极反应是________。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环,则A物质的化学式是_________。实验过程中,若通入了标准状况下空气448 L(假设空气中O2体积分数为20%),则熔融盐燃料电池消耗标准状况下CH4____________L。
(1)BD(2分) (2)0≤x<3(2分)
(3)CO2(g)+4 H2(g)=CH4(g)+2H2O(l) △H=-252.9 kJ/mol(2分)
(4)2O2+4CO2+8e-=CO32-(2分)、CO2(1分)、44.8L(2分)
【解析】
试题分析:(1)A、由图可知,平衡时△c(CO)=0.2mol/L-0.08mol/L=0.12mol/L,浓度变化量之比等于化学计量数之比,故△c(H2)=△c(CO)=0.12mol/L,则n(H2)=0.12mol/L×10L=1.2mol,故A错误;B、生成1.2mol氢气,放出的热量为41.2kJ/mol×1.2mol=49.44kJ,故B正确;C、由图可知4min时到达平衡,随反应进行,混合气体总质量不变,总物质的量也不变,所以平均相对分子质量始终不变,故C不正确;D.该反应正反应是放热反应,升高温度平衡向逆反应移动,平衡常数减小,故D正确;E、第8min时,若充入氦气,压强增大,但物质的浓度不变,因此反应速率和平衡都不变,E不正确,答案选BD。
(2)由图可知,平衡时CO的浓度为0.08mol/L,则:
CO(g)+H2O(g)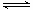 H2(g)+CO2(g)
H2(g)+CO2(g)
起始浓度(mol/L) 0.2 0.3 0 0
转化浓度(mol/L) 0.12 0.12 0.12 0.12
平衡浓度(mol/L) 0.08 0.18 0.12 0.12
故平衡常数K=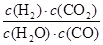 =
=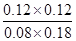 =1
=1
平衡向正反应方向移动,浓度商小于平衡常数,即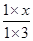 <1,解得x<3,所以x的取值范围是0≤x<3。
<1,解得x<3,所以x的取值范围是0≤x<3。
(3)根据已知反应①CH4(g)+2O2(g)=CO2(g)+ 2H2O(l) ΔH1=-890.3 kJ/mol、②H2(g)+1/2O2(g)=H2O(l) ΔH2=-285.8 kJ/mol并结合盖斯定律可知,②×4-①即得到CO2(g)+4 H2(g)
=CH4(g)+2H2O(l),则该反应的反应热△H=-285.8 kJ/mol×4+890.3 kJ/mol=-252.9 kJ/mol。
(4)原电池中正极得到电子,则氧气在正极通入。由于是以熔融碳酸盐为电解质,所以氧气在正极得到电子结合CO2生成CO32-,则正极电极反应式为2O2+4CO2+8e-=4CO32-。由于负极产生CO2,而正极消耗CO2,所以参加循环的物质应该是CO2;448L空气中氧气的体积=448L×20×=89.6L,标准状况下的体积=89.6L÷22.4L/mol=4mol,反应中得到4mol×4=16mol电子。甲烷在反应中失去8个电子,所以根据电子得失守恒可知,消耗甲烷的物质的量是16mol÷8=2mol,在标准状况下的体积是44.8L。
考点:考查可逆反应的计算、外界条件对平衡状态的影响、热化学方程式的计算以及燃料电池的有关判断


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江西省高三模拟考试(理综)化学部分 题型:填空题
(15分)由于燃料电池汽车,尤其氢燃料电池汽车可以实现零污染排放,驱动系统几乎无噪音,且氢能取之不尽、用之不竭,燃料电池汽车成为近年来汽车企业关注的焦点。为了获得竞争优势,各国纷纷出台政策,加速推进燃料电池关键技术的研发。燃料电池的燃料有氢气、甲醇、汽油等。
(1)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇,甲醇是汽车燃料电池的重要燃料。已知氢气、甲醇燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(l) △H= -571.6kJ·mol-1 ①
CH3OH(l)+ O2(g)→CO2(g)+2H2O(l) △H= -726.0kJ·mol-1 ②
写出二氧化碳与氢气合成甲醇液体的热化学方程式:_______________________。
(2)有科技工作者利用稀土金属氧化物作为固体电解质制造出了甲醇一空气燃料电池。这种稀土金属氧化物在高温下能传导O2-。
①电池正极反应式为_______________,负极反应式为_______________。
②在稀土金属氧化物的固体电解质中,O2-的移动方向是___________ 。
③甲醇可以在内燃机中燃烧直接产生动力推动机动车运行,而科技工作者却要花费大量的精力研究甲醇燃料汽车。主要原因是:_________________________________
查看答案和解析>>
科目:高中化学 来源:江西省模拟题 题型:填空题
 H2(g)+CO2(g) △H=-41.2kJ/mol ,制备CO2与H2 的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
H2(g)+CO2(g) △H=-41.2kJ/mol ,制备CO2与H2 的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
 CO2(g)+ 2H2O(l) ΔH1=-890.3 kJ/mol
CO2(g)+ 2H2O(l) ΔH1=-890.3 kJ/mol  H2O(l) ΔH2=-285.8 kJ/mol
H2O(l) ΔH2=-285.8 kJ/mol 查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省温州市八校联考高三(上)期末化学试卷(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com