
分析 根据n=$\frac{m}{M}$计算出氯化银、碳酸钙沉淀的物质的量;然后根据钙离子守恒计算出氯化钙的物质的量,再根据氯离子守恒计算出氯化钠的物质的量.
解答 解:8.61g AgCl的物质的量为:n(AgCl)=$\frac{8.61g}{143.5g/mol}$=0.06mol,
2.00g 碳酸钙的物质的量为:n(CaCO3)=$\frac{2.0g}{100g/mol}$=0.02mol,
根据钙离子守恒可知CaCl2的物质的量为:n(CaCl2)=n(CaCO3)=0.02mol;
氯离子来自氯化钙和氯化钠,根据氯离子守恒可知氯化钠的物质的量为:n(NaCl)=n(AgCl)-2n(CaCl2)=0.06mol-0.02mol×2=0.02mol,
答:原混合物中含有NaCl和CaCl2的物质的量都是0.02mol.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握质量守恒定律在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡常数减小 | B. | O2浓度增加 | C. | O2压强不变 | D. | BaO量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
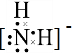 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2mol CO、1mol O2 | 2mol CO2 | 4mol CO2 |
| CO2的浓度(mol•L-1) | C1 | C2 | C3 |
| 反应的能量变化 | 放出aKJ | 吸收bKJ | 吸收CkJ |
| 体系压强(Pa) | P1 | P2 | P3 |
| A. | 2c1<c3 | B. | a+b=283.0 | C. | 2p2>p3 | D. | c1=c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
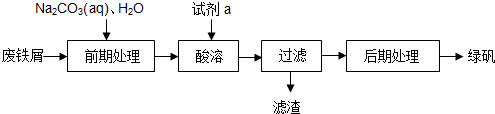
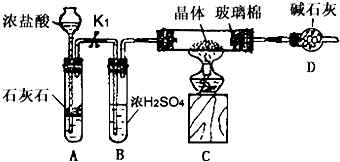
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com