
Ⅰ.实验室称取0.867 g草酸钠(Na2C2O4,式量为134),溶解于水,加入一定量硫酸,用未知浓度的KMnO4溶液滴定,用去KMnO4溶液22.50 mL,反应式如下(未配平):
MnO4- + C2O42- + H+ → Mn2+ + CO2 + H2O。
则装KMnO4的滴定管是_______(填“酸式”或“碱式”); KMnO4溶液的浓度是________mol/L。
Ⅱ.某温度下在容积固定的密闭容器中,下列反应达到平衡:M(g)+H2O(g)![]() N(g)+H2(g)
N(g)+H2(g)
| 起始n(M):n(H2O) | M转化率 | H2O转化率 |
| 1:1 | 0.5 | 0.5 |
| 1:2 | 0.67 | 0.33 |
| 1:3 | 0.75 | 0.25 |
①该反应的平衡常数为 。该温度下,向容器中充入1molM、3mol H2O、2mol N、1.5molH2,则起始时该反应速率V正 V逆(填“>”、“<”或“=”)
②结合表中数据,判断下列说法中正确的是 。
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的量之比为1:4时,M的转化率为0.85
③该温度下,向容器中充入2molM、2mol H2O ,当达平衡时放出a KJ热量,则该反应的
△H=
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
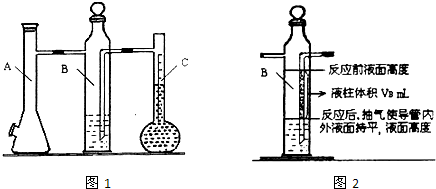
| 实验次数 | m(Mg)/g | 硫酸体积/mL | 液体量瓶中液体体积/mL | 抽出气体体积/mL | 氢气体积/mL | 计算1mol氢体积/L |
| 1 | 0.100 | 10.0 | 110.0 | 6.5 | X | |
| 2 | 0.115 | 10.0 | 121.0 | 8.0 |
| 实验次数 | m(Mg) g |
硫酸体积mL | 液体量瓶中液体体积mL | 抽出气体体积mL | B瓶的一段液柱体积mL | 水汽体积百分含量 | 计算1mol氢体积L |
| 1 | 0.100 | 10.0 | 110.0 | 6.5 | VB | a% |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室配制500 mL 0.2 mol·L-1的FeSO4溶液,操作步骤有:①在天平上称取27.8 g绿矾,把它放在烧杯里,用适量的蒸馏水把它完全溶解。②把制得的溶液小心地注入500 mL容量瓶中。③继续向容量瓶中加入蒸馏水,至液面距刻度1 cm—2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。④用少量蒸馏水洗涤烧杯和玻璃棒2—3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。⑤将容量瓶塞紧,充分摇匀。请填写下列空白:
(1)操作步骤的正确顺序为(填序号):____________________________________________。
(2)本实验用到的基本仪器有:__________________________________________________。
(3)若俯视刻度,对所配制溶液浓度的影响是______________(填“偏低”“偏高”或“无影响”)。
(4)若没有进行④的操作,其影响是________________________________________________。
(5)若实验中出现了下列情况应如何处理:加蒸馏水时不慎超过了刻度,应________________,向容量瓶中转移溶液时(实验步骤②)不慎有液滴溅在容量瓶外面,应____________________。
查看答案和解析>>
科目:高中化学 来源:2014届河北省唐山市高三年级摸底考试理综化学试卷(解析版) 题型:实验题
CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。
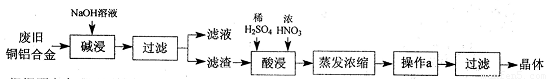
根据题意完成下列填空:
(1)“碱浸”的目的是 ,写出有关的离子方程式 。
(2)向滤渣中先加入足量稀硫酸,然后再滴加少量浓硝酸,在废渣溶解时可以观察到的实验现象有 。
(3)操作a的名称为 ,制得的CuSO4·5H2O中可能存在硝酸铜杂质,除去这种杂质的实验操作名称为 。
(4)已知:CuSO4+2NaOH=Cu(OH)2↓+ Na2SO4。称取0.26 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L盐酸滴定至终点,耗用盐酸8.00 mL,则该试样中CuSO4·5H2O的质量分数为 ;上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用 。
(5)在“酸浸”的步骤中,①若只加入浓硫酸,写出加热时的化学方程式 。
②若将浓硝酸换成过氧化氢,常温时即可生成硫酸铜,指出此种方法的优点 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com