
��֪��25��ʱ�� Ksp(FeS)=6.3��10-18��Ksp(CuS)=1.3��10-36��Ksp(ZnS)=1.6��10-24������������ȷ����
A��25��ʱ��FeS��ZnS��CuS���ܽ����������
B��ZnS������Һ���������Na2S���壬ƽ�����Һ��c(Zn2+)��c(S2-)=Ksp��c(Zn2+)=c(S2-)
C����ȥ��ҵ��ˮ�е�Cu2+������FeS��Ϊ������
D��ij��Һ�к���Fe2+��Cu2+��Zn2+��Ũ�Ⱦ�Ϊ0.010mol/L�������Һ����μ���0.010mol/L��Na2S��Һʱ��Fe2+���ȳ�������

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�������ʡ��һ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
���ִ�����Ⱦ��NO2��SO2��һ�������¿��Է������·�Ӧ��NO2+SO2= NO +SO3�������ΪV L���ܱ�������ͨ��3molNO2��5molSO2�� ��Ӧ�������ڵ�ԭ�Ӻ���ԭ�Ӹ�����Ϊ
A��3/10 B��16/3 C��3/16 D��5/16
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ������ʡ��һ��12���¿���ѧ�Ծ��������棩 ���ͣ������
��ͼ��ʾװ�ÿ�������ȡFe(OH)2�۲�Fe(OH)2�ڿ����б�����ʱ����ɫ�仯��ʵ��ʱ����ʹ����м��6 mol/L������Һ�������Լ���ѡ����д���пհף�
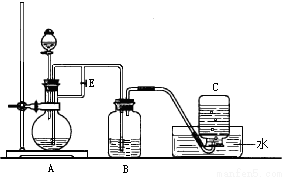
��1��B��ʢ��һ������NaOH��Һ��A��ӦԤ�ȼ�����Լ���___________��
��2��ʵ�鿪ʼʱӦ�Ƚ�����E______________(����رա�)
��3����������Fe(OH)2�IJ�������________________________________
��4����ȥװ��B�е���Ƥ����ʹ�������룬д���йط�Ӧ�Ļ�ѧ����ʽ��_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����һ�и�һ��12��ѧҵ���л�ѧ���������棩 ���ͣ������
I. ��д���з�Ӧ�Ļ�ѧ����ʽ
��1�� ��FeCl3��Һ��Ϊ��ʴҺ����ͭӡˢ��·�� ��
��2�� ��ҵ�ϴֹ����ȡ��
II. �����йص����ӷ���ʽ��д
��1�� Ba(OH)2��Һ��NaHSO4��Һ��Ӧ����Һ�����ԣ�
���ӷ���ʽ ��
��2�� Ca(HCO3)2��Һ������NaOH��Һ��Ӧ
���ӷ���ʽ ��
��3�� Al2(SO4)3��Һ�����NaOH��Һ��Ӧ
���ӷ���ʽ ��
��ѧ���⣩��д�������ӷ���ʽ�Ĺؼ��ǣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������и�����12��ѧҵ���л�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£�1 mol��ѧ���ֽ����̬ԭ������Ҫ��������E��ʾ����ϱ�����Ϣ�ж�����˵������ȷ����
���ۼ� | H��H | F��F | H��F | H��Cl | H��I |
E(kJ��mol -1 ) | 436 | 157 | 568 | 432 | 298 |
A��432 kJ��mol -1��E(H��Br)��298 kJ��mol -1
B���������ȶ��Ĺ��ۼ���H��F��
C��H 2(g)��2H(g) ��H����436 kJ��mol -1
D��H2(g)��F2(g)��2HF(g) ��H����25 kJ��mol -1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ɽ��ʡ������ѧ��12�½β⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
ij��Һ���ܺ���Cl����SO��CO��NH��Fe3����Al3����K����ȡ����Һ100 mL���������NaOH��Һ�����ȣ��õ�0.02 mol���壬ͬʱ�������ɫ���������ˣ�ϴ�ӣ����գ��õ�1.6 g���壻��������Һ�м�����BaCl2��Һ���õ�4.66 g����������ij������ɴ˿�֪ԭ��Һ��
A�����ٴ���5������
B��SO��NHһ�����ڣ�Cl�����ܲ�����
C��Cl��һ�����ڣ���c(Cl��)��0.4 mol��L��1
D��CO��Al3��һ�������ڣ�K�����ܴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016�꺣��ʡ��һ�ϵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ�У���ȷ����
A���������ᷴӦ��2Fe+6H+=2Fe3++3H2��
B���Ȼ�����Һ������Ӧ��Fe3++Fe = 2Fe2+
C������������ϡ���ᷴӦ��FeO+2H+=Fe3++H2O
D���Ȼ�����Һ��ͭ��Ӧ��2Fe3++Cu=2Fe2++Cu2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016�꽭��ʡ�߶���12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����Ա����ж���ҽԺ�г������ᱵ���ֱ�����Ϊ�ڷ���Ӱ����ҽԺ���ȱ������ж�����ʱ���������⣬����Ҫ���ж���θ�й�����������Һ����֪��Ksp(BaCO3)��5.1��10��9��Ksp(BaSO4)��1.1��10��10�������ƶ���ȷ����
A������̼�ᱵ��Ϊ�ڷ���Ӱ��������ΪKsp(BaCO3)��Ksp(BaSO4)
B�����ȱ������ж�����ʱ����û�������ƣ�������̼������Һ����
C��������c(Ba2��)��1.0��10��5 mol/L����Һʱ�������������ж�
D��������0.36 mol/L��Na2SO4��Һ���������ж�����ϴθ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�긣��ʡ��һ�ϵڶ����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����һ�����ʵ���Ũ�ȵ���Һʱ�����ڲ���������ʹҺ���Գ���������ƿ�Ŀ̶�(����)����ʱӦ��ȡ�Ĵ�ʩ�� �� ��
A������������ϵ�Һ�� B�������������ϵ���Һ
C��Ӱ�첻���ٴ��� D����������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com