
T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增,其相关信息如下表:
|
元素 |
相关信息 |
|
T |
T原子所处的周期数、族序数分别与其原子序数相等 |
|
X |
X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
|
Z |
Z的基态原子价电子排布为 |
|
Q |
在该元素所在周期中,Q的基态原子的第一电离能最小 |
|
R |
3p能级上有1个电子 |
|
W |
W的一种核素的质量数为65,中子数为36 |
(1)X、Y、Q三种元素的电负性由大到小的顺序是 (用元素符号表示)。
(2)X与Y原子结合形成的X3Y4晶体,其硬度比金刚石大,则X3Y4晶体中含有 键(填“共价”、“离子”、“金属”),属于 晶体(填“分子”、“原子”、“离子”)。
(3)W的基态原子的核外电子排布式为 。利用电解可提纯W物质,在该电解反应中阳极物质是 ,阴极物质是 ,电解质溶液是 。
(4)T、X两种元素组成的一种化合物M是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,则M分子中 键和
键和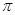 键的个数比为 。在T—Y、T—Z两种共价键中,键长较长的是
。
键的个数比为 。在T—Y、T—Z两种共价键中,键长较长的是
。
(5)已知25℃、101 kPa条件下:
4R(s)+3Z2(g) 2R2Z3(s) △H=-2834.9 kJ/mol
4R(s)+2Z3(g) 2R2Z3(s) △H=-3119.1 kJ/mol
则16g Z2(g)完全转化为Z3(g)的△H= .
(1)N>C>Na(2分)
(2)共价(1分);原子(1分)
(3)[Ar]3d104s1或1s22s22p63s23p63d104s1(2分);
粗铜 (1分); 精铜(1分);CuSO4溶液(或可溶性的铜盐)(1分)
(4)5:1 (2分) ;H-N(1分)
(5)47.4 kJ/mol(2分)
【解析】本题考查元素物质结构与元素周期率。T、X、Y、Z、Q、R、W依次为H、C、N、O、Na、Cl、Cu。同一周期电负性递增,同主族电负性减弱,电负性:N>C>Na;C3N4晶体硬度比金刚石大,说明C3N4晶体为共价键形成的原子晶体;Cu的基态原子的核外电子排布式为[Ar]3d104s1,电解精炼可提纯Cu,即是从粗铜中精炼铜,故该电解反应中阳极物质是粗铜、阴极物质是精铜,电解质溶液则是可溶性的铜盐;H2C=CH2分子中5个σ键和1个π键,原子半径:N>O ,因此键长较长的是H-N;上式减下式得 3O2(g)===2O3(g)ΔH=284.2 kJ/mol,
可知,0.5mol O2(g)完全转化为O 3(g)的ΔH=47.4 kJ/mol。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:阅读理解
| 元素 | 相 关 信 息 |
| T | T原子所处的周期数、族序数分别与其原子序数相等 |
| X | X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z | Z可形成Z2、Z3两种气态单质 |
| Q | 在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R | R的离子为单核离子,且离子半径是与其具有相同电子层结构离子中半径最小的 |
| P | Z是P不同周期的邻族元素;R和P的原子序数之和为30 |
| W | W的一种核素的质量数为56,中子数为30 |
| a+3b |
| 2 |
| a+3b |
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| T | T原子所处的周期数、族序数分别与其原子序数相等 |
| X | X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z | Z可形成Z2、Z3两种气态单质 |
| Q | 在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R | 3p能级上有1个电子 |
| W | W的一种核素的质量数为56,中子数为30 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| T | T原子所处的周期数、族序数分别与其原子序数相等 |
| X | X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z | Z的基态原子价电子排布为ns2npn+2 |
| Q | 在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R | 3p能级上有1个电子 |
| W | W的一种核素的质量数为65,中子数为36 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省温州市高三上学期期初考试化学试卷(解析版) 题型:填空题
(8分)T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增。已知:
①W的原子序数为29,其余的均为短周期主族元素;
②T原子所处的周期数、族序数分别与其原子序数相等;
③X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同;
④Z的基态原子价电子排布为ns2npn+2;
⑤在该元素所在周期中,Q的基态原子的第一电离能最小;
⑥R的单质常温常压下是气体,其基态原子的M层上有1个未成对的p电子;
(1)X、Y、Q三种元素的电负性由大到小的顺序是 (用元素符号表示)。
(2)Y的氢化物分子间能形成氢键,R的氢化物分子间不易形成氢键,原因是 。
(3)W的基态原子的核外电子排布式为 。
(4)T、X、Z三种元素组成的一种化合物M是新装修居室中常见的有害气体,它的分子式为XT2Z,分子空间构型为平面三角形,1molM分子中σ键和π键的个数比为 。
(5)X与Y原子结合形成的X3Y4晶体,其晶体结构与金刚石类似,但硬度比金刚石大,请解释原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com