
(10分)实验室用乙醇与浓硫酸共热制取乙烯,常因温度过高生成少量SO2,有人设计了如下图所示实验,以验证上述混合气体中是否含有乙烯和SO2。
(1)装置中X仪器的名称是: ;碎瓷片的作用是: 。
(2)写出生成乙烯的反应方程式: 。
(3)A、B、C、D装置中可盛放的试剂是(从下列所给试剂中选出,填序号):
①品红溶液,②NaOH溶液,③溴水,④KMnO4酸性溶液。
A. ;B. ;C. ;D. 。
(4)能说明SO2气体存在的现象是 。
(5)确证含有乙烯的现象是 。
科目:高中化学 来源: 题型:
(14分)1-乙氧基萘是一种无色液体,密度比水大,不溶于水,易溶于醇、醚,熔点5.5 ℃,沸点267.4 ℃。1-乙氧基萘常用作香料,也可作为合成其他香料的原料。实验室制备1-乙氧基萘的过程如下:
(1)将混合液置于如图所示的容器中加热充分反应。实验中使用过
量乙醇的原因是 。烧瓶上连接长直玻璃管的主要
作用是 。
(2)反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏②水洗并分液③用10%的NaOH溶液碱洗并分液 ④用无水氯化钙干燥并过滤。正确的顺序是 。
A.③②④① B.①②③④ C.②①③④
(3)蒸馏时所用的玻璃仪器除了酒精灯、冷凝管、接收器、
锥形瓶外还有 , 。
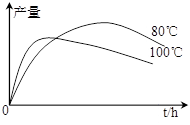
(4)实验测得1-乙氧基萘的产量与反应时间、温度的变化
如图所示,时间延长、温度升高1-乙氧基萘的产量下
降的原因可能是 、 。
(5)用金属钠可检验1-乙氧基萘是否纯净,简述实验现象与结论: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)1-乙氧基萘是一种无色液体,密度比水大,不溶于水,易溶于醇、醚,熔点5.5 ℃,沸点267.4 ℃。1-乙氧基萘常用作香料,也可作为合成其他香料的原料。实验室制备1-乙氧基萘的过程如下:
(1)将混合液置于如图所示的容器中加热充分反应。实验中使用过量乙醇的原因是 。 烧瓶上连接 长直玻璃管的主要作用是 。
(2)反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏②水洗并分液③用10%的NaOH溶液碱洗并分液 ④用无水氯化钙干燥并过滤。正确的顺序是 。
A.③②④① B.①②③④ C.②①③④
(3)蒸馏时所用的玻璃仪器除了酒精灯、冷凝管、接收器、锥形瓶外还有 。
(4)实验测得1-乙氧基萘的产量与反应时间、温度的变化 如图所示,时间延长、温度升高1-乙氧基萘的产量下降的原因可能是 、 。
(5)用金属钠可检验1-乙氧基萘是否纯净,简述实验现象 与结论: 。
查看答案和解析>>
科目:高中化学 来源:2011-2012年江苏省无锡市高一下学期期中考试化学试卷(解析版) 题型:填空题
(10分)短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):
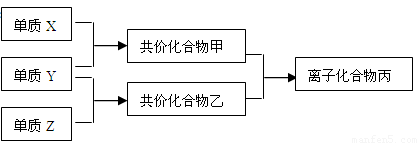
已知:a. 常见双原子单质分子中,X分子含共用电子对数目最多。
b. 甲分子含10个电子,乙分子含18个电子。
(1)X的结构式: ;丙的电子式:
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。
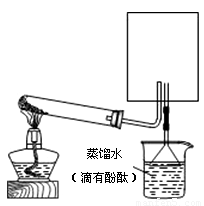
①在右图中方框内绘出用烧瓶收集甲的仪器装置简图。
②试管中发生反应的化学方程式是:
③烧杯中溶液由无色变为红色,其原因是:(用电离方程式表示)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省高三上学期11月月考试卷(解析版) 题型:实验题
(11分)实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)理论上硫酸和硝酸的物质的量之比最佳为: ︰ ;
(2)实际上,即使铜粉、硫酸及硝酸都比较纯净,制得的CuSO4·5H2O中还是有可能存在的杂质是 ,除去这种杂质的实验操作称为 。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
方案甲:以空气为氧化剂。将铜粉在___________(填仪器名称)中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案乙:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH ,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
已知:Ksp[Cu((OH)2]≈10-22, Ksp[Fe((OH)2]≈10-16, Ksp[Fe((OH)3]≈10-38
请回答下列问题:
①为了使铁元素全部沉淀,应调节pH至少为_________;
②甲物质可选用的是 ;
A.CuCl2 B.NaOH C.Cu2(OH)2CO3 D.CuO E.H2SO4
③反应中加入少量FeSO4对铜的氧化可以起催化作用。其反应过程是:第1步,4Fe2++O2+4H+==4Fe3++2H2O,请写出其第2歩反应的离子方程式 。
方案丙:将铜丝放到一定量的稀硫酸中,加入适量的H2O2,并控温在50℃~60℃,持续反应1 h,也能获得硫酸铜。请回答下列问题:
④反应时温度必须控制在50℃~60℃,温度不宜过高的主要原因是 ;
⑤写出该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省湖州市高三上学期期中考试化学试卷 题型:实验题
(11分)实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)理论上硫酸和硝酸的物质的量之比最佳为: ︰ ;
(2)实际上,即使铜粉、硫酸及硝酸都比较纯净,制得的CuSO4·5H2O中还是有可能存在的杂质是 ,除去这种杂质的实验操作称为 。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
方案甲:以空气为氧化剂。将铜粉在___________(填仪器名称)中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案乙:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH ,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
已知:Ksp[Cu((OH)2]≈10-22, Ksp[Fe((OH)2]≈10-16, Ksp[Fe((OH)3]≈10-38
请回答下列问题:
①为了使铁元素全部沉淀,应调节pH至少为_________;
②甲物质可选用的是 ;
A.CuCl2 B.NaOH C.Cu2(OH)2CO3 D.CuO E.H2SO4
③反应中加入少量FeSO4对铜的氧化可以起催化作用。其反应过程是:第1步,4Fe2++O2+4H+==4Fe3++2H2O,请写出其第2歩反应的离子方程式 。
方案丙:将铜丝放到一定量的稀硫酸中,加入适量的H2O2,并控温在50℃~60℃,持续反应1 h,也能获得硫酸铜。请回答下列问题:
④反应时温度必须控制在50℃~60℃,温度不宜过高的主要原因是 ;
⑤写出该反应的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com