
已知A经如右图所示的过程转化为D, 
请回答下列问题:
(1)若A为非金属单质,且常温下为淡黄色固体,B为刺激性气味的无色气体,能使品红溶液褪色,D为强酸。
①D的化学式是 。
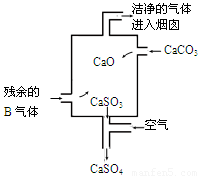
②在工业生产中B气体的大量排放被雨水吸收后形成了 而污染了环境。某工厂净化残余的B气体装置如图,则除去B气体的总反应方程式是 。
(2)若A是能使酚酞试液变红的气体。D是一种强酸。写出A→B的化学方程式 ;工业生产上,以34吨A为原料,最多可以生产63%的D酸 吨。
(1)①H2SO4 (2分) ②酸雨(1分);2SO2 +2CaCO3+O2 = 2CaSO4+2CO2(2分)
(2) 4NH3 +5O2
 4NO+6H2O
(2分);200(2分)
4NO+6H2O
(2分);200(2分)
【解析】
试题分析:(1)若A为非金属单质,且常温下为淡黄色固体,则A是单质S。硫在氧气中燃烧生成SO2,SO2是刺激性气味的无色气体,则B是SO2,SO2能使品红溶液褪色。SO2氧化得到三氧化硫,三氧化硫溶于水生成硫酸,即D为强酸硫酸。
①D的化学式是H2SO4。
②在工业生产中SO2气体的大量排放被雨水吸收后形成了酸雨而污染了环境。根据示意图可知,碳酸钙高温分解生成氧化钙和CO2,氧化钙吸收SO2生成亚硫酸钙。亚硫酸钙不稳定,被空气中的氧气氧化生成硫酸钙,从而防止空气污染,因此反应的总化学方程式为2SO2 +2CaCO3+O2=2CaSO4+2CO2。
(2)若A是能使酚酞试液变红的气体,则A是氨气。氨气在氧气中发生催化氧化生成NO和水。NO被氧气氧化生成NO2,NO2溶于水生成强酸硝酸,因此A→B的化学方程式为4NH3 +5O2
 4NO+6H2O。根据氮原子守恒可知:
4NO+6H2O。根据氮原子守恒可知:
NH3~~~~HNO3
17t 63t
34t m×63%
解得m=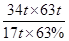 =200t
=200t
考点:考查无机框图题的判断、化学用语的书写以及硝酸制备的有关计算等


科目:高中化学 来源:2013届江西省南昌二中高三第一次考试化学试卷(带解析) 题型:填空题
(8分)含氯消毒剂和过氧化物等强氧化性消毒剂可防甲型H1N1流感。
(1)过碳酸钠是一种有多种用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。
①H2O2有时可作为矿业废液消毒剂,如消除采矿业废液中的氰化物(如NaCN),经以下反应实现:NaCN+H2O2+H2O===A+NH3↑,则生成物A的化学式为_______________,
②某强酸性反应体系中,反应物和生成物共六种物质:O2、MnO、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→ O2。写出该反应的离子方程式:_________。
(2)某天然碱的化学式可表示为:aNa2CO3·bNaHCO3·2H2O,取m g天然碱溶于水配成溶液,再向溶液中逐滴加入1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系某同学作出了如右图所示的A和B曲线,试回答下列问题:
①_______曲线正确,天然碱的化学式为___________,
③加盐酸后产生CO2气体体积(标准状况)的最大值为_________________mL。
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。
亚氯酸不稳定可分解,反应的离子方程式为:HClO2―→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子个数是________。
查看答案和解析>>
科目:高中化学 来源:2013届江西省江西师大附中、临川一中高三12月联考化学试卷(带解析) 题型:填空题
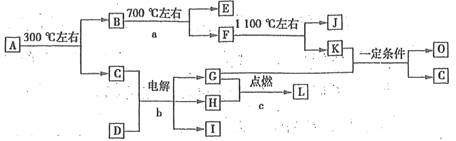
(7分)化合物A是尿路结石的主要成分,属于结晶水合物,可用X·nH2O表示。在一定条件下有如下图所示的转化关系: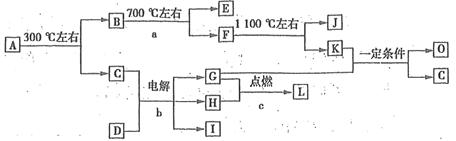
已知:①上图中的各字母代表的物质均由常见元素(原子序数≤20)组成,其中X由三种元素组成;A、D晶体中阴、阳离子个数比都是l:1;D中的阳离子与C分子有相同的电子数,A中的阳离子与D中的阴离子的电子层结构相同。
②G、H是常见的气体单质,E、K、L是常见的气体化合物;E被人体吸入,会与血红蛋白结合而使人中毒,K的大量排放是造成地球温室效应的主要原因。
③反应b、c是重要的化工反应,I是一种重要的化工原料。
④转化关系图中的部分变化经定量测定,得到如右图所示的固体产物的质量分数[ (%)]随温度[T(℃)]的变化曲线。
(%)]随温度[T(℃)]的变化曲线。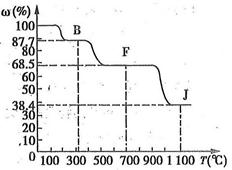
回答下列问题:
(1)写出A的化学式: ,D阴离子的示意图 。
(2)反应a的化学方程式为 。
(3)写出电解反应b的化学方程式,并标出电子转移的方向和数目: 。
(4)K与G在一定条件下可生成多种物质,既可获得经济效益,也可减少对环境的污染。若O是一种易挥发的液态燃料,有毒,误饮5~10mL会导致双目失明。则O的分子式为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省、临川一中高三12月联考化学试卷(解析版) 题型:填空题
(7分)化合物A是尿路结石的主要成分,属于结晶水合物,可用X·nH2O表示。在一定条件下有如下图所示的转化关系:
已知:①上图中的各字母代表的物质均由常见元素(原子序数≤20)组成,其中X由三种元素组成;A、D晶体中阴、阳离子个数比都是l:1;D中的阳离子与C分子有相同的电子数,A中的阳离子与D中的阴离子的电子层结构相同。
②G、H是常见的气体单质,E、K、L是常见的气体化合物;E被人体吸入,会与血红蛋白结合而使人中毒,K的大量排放是造成地球温室效应的主要原因。
③反应b、c是重要的化工反应,I是一种重要的化工原料。
④转化关系图中的部分变化经定量测定,得到如右图所示的固体产物的质量分数[ (%)]随温度[T(℃)]的变化曲线。
(%)]随温度[T(℃)]的变化曲线。

回答下列问题:
(1)写出A的化学式: ,D阴离子的示意图 。
(2)反应a的化学方程式为 。
(3)写出电解反应b的化学方程式,并标出电子转移的方向和数目: 。
(4)K与G在一定条件下可生成多种物质,既可获得经济效益,也可减少对环境的污染。若O是一种易挥发的液态燃料,有毒,误饮5~10mL会导致双目失明。则O的分子式为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省高三第一次考试化学试卷(解析版) 题型:填空题
(8分)含氯消毒剂和过氧化物等强氧化性消毒剂可防甲型H1N1流感。
(1)过碳酸钠是一种有多种用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。
①H2O2有时可作为矿业废液消毒剂,如消除采矿业废液中的氰化物(如NaCN),经以下反应实现:NaCN+H2O2+H2O===A+NH3↑,则生成物A的化学式为_______________,
②某强酸性反应体系中,反应物和生成物共六种物质:O2、MnO、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→ O2。写出该反应的离子方程式:_________。
(2)某天然碱的化学式可表示为:aNa2CO3·bNaHCO3·2H2O,取m g天然碱溶于水配成溶液,再向溶液中逐滴加入1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系某同学作出了如右图所示的A和B曲线,试回答下列问题:

①_______曲线正确,天然碱的化学式为___________,
③加盐酸后产生CO2气体体积(标准状况)的最大值为_________________mL。
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。
亚氯酸不稳定可分解,反应的离子方程式为:HClO2―→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子个数是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com