
【题目】如图是制备乙炔和研究乙炔性质的实验装置图,下列有关说法错误的是( )
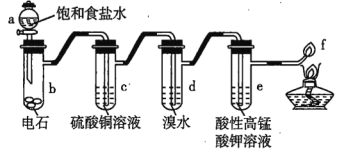
A.a中用饱和食盐水代替蒸馏水可使产生乙炔的速率更易控制
B.c中CuSO4 溶液的作用是除去影响后续实验的杂质
C.d、e中溶液褪色的原理不同,前者是氧化反应,后者是加成反应
D.f 处产生明亮、伴有浓烟的火焰
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式不正确的是
A.向铁制器具上电镀铜,阴极的电极反应为:Cu2++2e-=Cu
B.电解饱和食盐水获取烧碱和氯气:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C.饱和Na2CO3溶液与CaSO4固体反应:CO32-(aq)+CaSO4(s)![]() CaCO3(s)+SO42-(aq)
CaCO3(s)+SO42-(aq)
D.向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++SO42- =BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,利用电化学催化方法进行CO2转化的研究引起了世界范围内的高度关注。下图是以Cu作为催化剂CO2转化为甲酸的反应过程,下列有关说法不正确的是
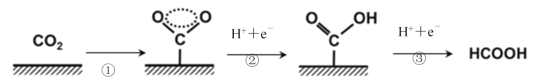
A.过程①说明在催化剂作用下,O-C-O之间形成了一种特殊的化学键
B.过程②和③吸收了能量并形成了O-H键和C-H键
C.CO2和HCOOH中均只含有极性共价键
D.每1molCO2完全转化为甲酸需得2mole-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“烂板液”指的是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量Cl-、Fe3+)。某化学兴趣小组用“烂板液”制取Zn(NO3)2·6H2O的过程如图:
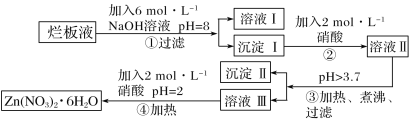
已知:Zn(NO3)2·6H2O是一种无色晶体,其水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
(1)“烂板液”中溶质的主要成分是___(填化学式)。
(2)在操作①中保持pH=8的目的是___。
(3)沉淀Ⅰ的主要成分是___(填化学式)。
(4)操作③中加热煮沸的目的是___;
(5)操作④保持pH=2的目的是___;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研团队研制出“TM﹣LiH(TM表示过渡金属)”双催化剂体系,显著提高了在温和条件下氮气和氢气合成NH3的效率,原理示意如下:

下列分析不合理的是( )
A.状态Ⅰ,吸收能量并有N≡N键发生断裂B.合成NH3总反应的原子利用率是100%
C.“TM﹣LiH”能降低合成氨反应的△HD.生成NH3:2LiNH+3H2═2LiH+2NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知还原性:![]() ,某溶液中含如下离子组中的几种
,某溶液中含如下离子组中的几种![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,某同学欲探究该溶液的组成进行了如下实验:
,某同学欲探究该溶液的组成进行了如下实验:
①用铂丝醮取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰;
②另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成;
③取②反应后溶液置于试管中加入![]() ,充分振荡静置后溶液分层,下层为无色。
,充分振荡静置后溶液分层,下层为无色。
下列说法正确的是( )
A.②中无色气体是![]() 气体,可能含有
气体,可能含有![]() 气体
气体
B.原溶液中![]() 与
与![]() 只存在一种离子
只存在一种离子
C.原溶液中![]() 与
与![]() 至少存在一种离子
至少存在一种离子
D.为确定是否含有![]() 可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀
可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于![]() 水解的说法错误的是( )
水解的说法错误的是( )
A.在稀溶液中,水解达到平衡时,无论加![]() 饱和溶液还是加水稀释,平衡均向右移动
饱和溶液还是加水稀释,平衡均向右移动
B.浓度为![]() 和
和![]() 的两种
的两种![]() 溶液,其他条件相同时,
溶液,其他条件相同时,![]() 的水解程度前者小于后者
的水解程度前者小于后者
C.其他条件相同时,同浓度的![]() 溶液在50 ℃和20 ℃时发生水解,50 ℃时
溶液在50 ℃和20 ℃时发生水解,50 ℃时![]() 的水解程度比20 ℃时的小
的水解程度比20 ℃时的小
D.为抑制![]() 的水解,更好地保存
的水解,更好地保存![]() 溶液,应加少量盐酸
溶液,应加少量盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,某反应达到了化学平衡,其反应过程对应的能量变化如图。下列说法正确的是
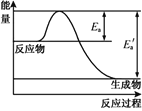
A.Ea为逆反应活化能,E为正反应活化能
B.该反应为放热反应,ΔH=Ea’-Ea
C.所有活化分子的平均能量高于或等于所有分子的平均能量
D.温度升高,逆反应速率加快幅度大于正反应加快幅度,使平衡逆移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com