
已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(G)![]() CH3OH(g)+H2O(g);ΔH=-187.4 kJ·mol-1.300℃时.密闭容器中,当C(CO2)=1.00 mol·L-1C(H2)=1.60 mol·L-1开始反应,结果如下图所示,回答下列问题:
CH3OH(g)+H2O(g);ΔH=-187.4 kJ·mol-1.300℃时.密闭容器中,当C(CO2)=1.00 mol·L-1C(H2)=1.60 mol·L-1开始反应,结果如下图所示,回答下列问题:
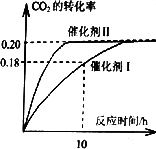
(1)使用催化剂Ⅰ时,反应在10小时内的平均反应速率:V(H2)=________mol·(L·h)-1.
(2)下列叙述正确的是________.
A
.容器内气体的密度不再改变时,反应不一定达到平衡状态B.充人氩气増大压强有利于提髙CO2的转化率
C
.CO2平衡转化率:在上述反应条件下,催化剂Ⅱ比催化剂Ⅰ高D
.催化效率:在上述反应条件下,催化剂Ⅱ比催化剂Ⅰ高(3)将上述平衡体系升温至400℃,平衡常数:K(400℃)________K(300℃)(填<、=或>).
(4)已知:2H2(g)+O2(g)=2H2O(g);ΔH=-242.8 kJ·mol-1则反应2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g);ΔH=________kJ·mol-1.
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
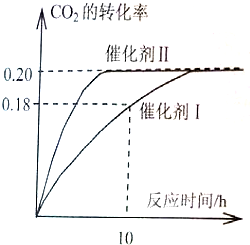 已知CO2可以生产绿色燃料甲醇.
已知CO2可以生产绿色燃料甲醇.查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省广州六中高二上学期期末考试理科化学试卷(带解析) 题型:填空题
已知CO2可以生产绿色燃料甲醇。CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH=-187.4 kJ/mol。3000C时的恒容密闭容器中,当C(CO2) = 1.00 mol.L-1 C(H2) =" 1.60" mol.L-1开始反应,结果如右图所示,回答下列问题:
CH3OH(g) + H2O(g) ΔH=-187.4 kJ/mol。3000C时的恒容密闭容器中,当C(CO2) = 1.00 mol.L-1 C(H2) =" 1.60" mol.L-1开始反应,结果如右图所示,回答下列问题:
(1)使用催化剂I时,反应在10小时内的平均反应速率:V(H2)= ______mol.(L.h)-1。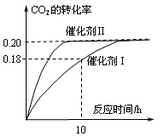
(2)下列叙述正确的是______。(双选)
A.当容器内气体的密度不再改变时,反应不一定达到平衡状态
B.充入氩气増大压强有利于提髙CO2的转化率
C.CO2平衡转化率:在上述反应条件下,催化剂II比催化剂I高
D.催化效率:在上述反应条件下,催化剂II比催化剂I高
(3)根椐图中数据,计算此反应在3000C时的平衡常数。(写出计箅过程)
(4)将上述平衡体系升温至400°C, 平衡常数:K(4000C) ______ K(3000C) (填<、=或> )。
(5)其它条件不变,若上述反应在催化剂Ⅱ,400°C下达到平衡,请在上图画出CO2转化率随时间变化图。
查看答案和解析>>
科目:高中化学 来源:2014届广东省高二上学期期末考试理科化学试卷(解析版) 题型:填空题
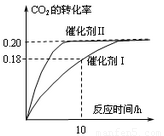
已知CO2可以生产绿色燃料甲醇。CO2(g) + 3H2(g) CH3OH(g) + H2O(g)
ΔH=-187.4 kJ/mol。3000C时的恒容密闭容器中,当C(CO2) = 1.00 mol.L-1 C(H2)
=" 1.60" mol.L-1开始反应,结果如右图所示,回答下列问题:
CH3OH(g) + H2O(g)
ΔH=-187.4 kJ/mol。3000C时的恒容密闭容器中,当C(CO2) = 1.00 mol.L-1 C(H2)
=" 1.60" mol.L-1开始反应,结果如右图所示,回答下列问题:
(1)使用催化剂I时,反应在10小时内的平均反应速率:V(H2)= ______mol.(L.h)-1。
(2)下列叙述正确的是______。(双选)
A.当容器内气体的密度不再改变时,反应不一定达到平衡状态
B.充入氩气増大压强有利于提髙CO2的转化率
C.CO2平衡转化率:在上述反应条件下,催化剂II比催化剂I高
D.催化效率:在上述反应条件下,催化剂II比催化剂I高
(3)根椐图中数据,计算此反应在3000C时的平衡常数。(写出计箅过程)
(4)将上述平衡体系升温至400°C, 平衡常数:K(4000C) ______ K(3000C) (填<、=或> )。
(5)其它条件不变,若上述反应在催化剂Ⅱ,400°C下达到平衡,请在上图画出CO2转化率随时间变化图。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com