【答案】
分析:(1)C、D两种气体均能使澄清石灰水变浑浊,为SO
2、CO
2,A为短周期组成的黑色固体物质,与B的浓溶液共热时,产生SO
2、CO
2两种气体,同时生成水,A为C单质,B为浓硫酸,符合转化关系;
(2)若A在水中的溶解度随温度升高而降低,考虑A为Ca(OH)
2,B为短周期非金属单质,D是漂白粉的成分之一,B为Cl
2,符合转化关系与题意,D能发生水解故D为Ca(ClO)
2;
(3)五核10电子的阳离子为NH
4+,与单核18电子的阴离子构成的无色晶体,受热易分解,分解后生成两种极易溶于水的气体,为NH
3、HCl,阴离子为Cl
-,A为NH
4Cl,B为碱符合转化关系.
解答:解:(1)C、D两种气体均能使澄清石灰水变浑浊,为SO
2、CO
2,A为短周期组成的黑色固体物质,与B的浓溶液共热时,产生SO
2、CO
2两种气体,同时生成水,A为C单质,B为浓硫酸,符合转化关系;
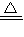
碳与浓硫酸在加热的条件下生成SO
2、CO
2、水,反应方程式为:C+2H
2SO
4(浓)
CO
2↑+2SO
2↑+2H
2O;
A、SO
2、CO
2都不能与氯化钡溶液反应,无法区别,故A错误;
B、SO
2能被酸性高锰酸钾溶液氧化,使酸性高锰酸钾褪色,CO
2不能反应,可以鉴别,故B正确;
C、SO
2能品红溶液褪色,CO
2不能使品红溶液褪色,可以鉴别,故C正确;
D、酸化的硝酸钡溶液通入SO
2,可以氧化亚硫酸钡为硫酸钡,产生白色沉淀,通入CO
2不反应,可以鉴别,故D正确;
故A不能鉴别;
CO
2的物质的量0.8mol,500mL2mol/L NaOH的水溶液中n(NaOH)=0.5L×2mol/L=1mol,n(CO
2):n(NaOH)=0.8mol:1mol=2:3=1:1.25,介于1:1与1:2之间,故反应生成碳酸钠与碳酸氢钠,令碳酸钠与碳酸氢钠的物质的量分别为amol、bmol,由钠离子守恒有2a+b=1,由碳元素守恒有a+b=0.8,联立方程,解得a=0.2,b=0.6,反应离子方程式为:
4CO
2+5OH
-=CO
32-+3HCO
3-+2H
2O;
碳酸根、碳酸氢根水解,溶液呈碱性c(OH
-)>c(H
+),碳酸根的水解程度比碳酸氢根的大,但水解程度很小,故c(HCO
3-)>c(CO
32-),c(CO
32-)原大于c(OH
-),溶液中钠离子难度最大,故:c(Na
+)>c(HCO
3-)>c(CO
32-)>c(OH
-)>c(H
+);
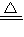
故答案为:C+2H
2SO
4(浓)
CO
2↑+2SO
2↑+2H
2O;A;
4CO
2+5OH
-=CO
32-+3HCO
3-+2H
2O;c(Na
+)>c(HCO
3-)>c(CO
32-)>c(OH
-)>c(H
+).
(2)若A在水中的溶解度随温度升高而降低,考虑A为Ca(OH)
2,B为短周期非金属单质,D是漂白粉的成分之一,B为Cl
2,符合转化关系与题意,D能发生水解故D为Ca(ClO)
2,Ca(ClO)
2发生水解的离子方程式为:ClO
-+H
2O?HClO+OH
-;
故答案为:ClO
-+H
2O?HClO+OH
-;
(3)五核10电子的阳离子为NH
4+,与单核18电子的阴离子构成的无色晶体,受热易分解,分解后生成两种极易溶于水的气体,为NH
3、HCl,阴离子为Cl
-,A为NH
4Cl,B为碱符合转化关系;
检验NH
4Cl中阴离子的检验方法是:配成溶液,取少量溶液于试管中,滴加硝酸银溶液产生白色沉淀,再滴加稀硝酸沉淀不溶解,说明含有Cl
-;
故答案为:配成溶液,取少量溶液于试管中,滴加硝酸银溶液产生白色沉淀,再滴加稀硝酸沉淀不溶解.
点评:本题以转化关系的形式考查S、Cu等元素单质及其化合物之间的相互转化关系、化学用语的书写能力,熟练掌握元素化合物知识是解题的关键,第(3)离子方程式的书写是本题的难点与易错点,判断氢氧化钠与二氧化碳的反应以生成物的物质的量关系,进行推理书写,对学生的逻辑推理能力提出较高要求.

 CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O; CO2↑+2SO2↑+2H2O;A;
CO2↑+2SO2↑+2H2O;A;

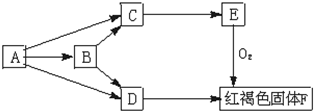 中学化学常见物质A、B、C、D、E有如下转化(已知A、B、C、D、E均含有同一元素):
中学化学常见物质A、B、C、D、E有如下转化(已知A、B、C、D、E均含有同一元素):