
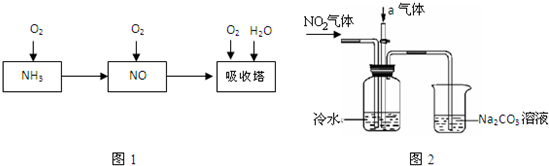
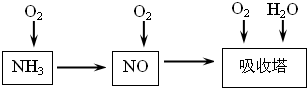
工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:
|


 (1)己知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式:______________________________________________;当温度升高时,该反应的平衡常数K值___________(填“增大”、“减小”或“不变”)。
(1)己知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式:______________________________________________;当温度升高时,该反应的平衡常数K值___________(填“增大”、“减小”或“不变”)。
(2)硝酸厂尾气常用的处理方法是催化还原法:催化剂存在时用H2将NO2还原为N2 。已知:
2H2(g)+O2(g)=2H2O(g) △H= a kJ·mol-1
N2(g)+2O2(g)=2NO2(g) △H= b kJ·mol-1
H2O(1)=H2O(g) △H= c kJ·mol-1
则反应2NO2(g)+4H2(g)=N2(g)+4H2O(1)的△H=_________。(用a、b、c表示)
(3)①合成氨反应的化学方程式为N2+3H2 2NH3,该反应在固定容积的密闭容器中进行。下列各项标志着该反应达到化学平衡状态的是____________(填序号)
2NH3,该反应在固定容积的密闭容器中进行。下列各项标志着该反应达到化学平衡状态的是____________(填序号)
A.容器内N2、H2、NH3的浓度之比为1∶3∶2
B.3v正(N2)=v逆(H2)
C.容器内压强保持不变
D.混合气体的相对分子质量保持不变
E.1mol N≡N键断裂,同时1mol H—H键断裂
②若在恒温条件下,将N2与H2按一定比例混合通入一个容积为2L的密闭容器中,5min反应达平衡,n(N2)=1mol,n(H2)=1mol,n(NH3)=2mol,则反应速率v(N2)=________________,H2的平衡转化率=_________________;若保持容器的温度不变,在10min时将容器的容积压缩为lL,请在答题卡坐标图中,画出从反应开始至15min时c(NH3)随时间变化曲线示意图。

(16分)
(1)4NH3+5O2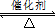 4NO
+ 6H2O (2分) 减小(2分)
4NO
+ 6H2O (2分) 减小(2分)
(2)(2a—b—4c)kJ/mol (2分,不写单位扣1分)
(3)①B C D(3分)
②0.1mol/(L·min) (2分,不写或写错单位0分) 75%(2分)

(共3分,前10min的曲线1分;10~15min的曲线2分,到达平衡的时间应小于15min,NH3平衡浓度小于2.67 mol/L)
【解析】
试题分析:(1)氨气具有还原性,与氧气在催化剂加热作用下发生反应,生成一氧化氮和水,该反应是氧化还原反应、可逆反应、放热反应,氮元素由—3升为+2价,氧元素由0降为—2价,根据最小公倍数法配平,则4NH3+5O2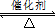 4NO
+ 6H2O;由于升高温度平衡向吸热方向移动,正反应是放热反应,则升高温度平衡向逆反应方向移动,则生成物浓度减小,反应物浓度增大,所以重新平衡时生成物浓度幂之积与反应物浓度幂之积的比值减小,即升高温度时该反应的平衡常数K减小;(2)先将4个热化学方程式分别编号为①②③④,由于①×2—②—③×4=④,根据盖斯定律,则④的焓变=①的焓变×2—②的焓变—③的焓变×4=(2a—b—4c)kJ/mol;(3)①容器内各组分浓度等于化学方程式的系数比,不能说明反应达到平衡,因为各组分变化浓度之比一定等于系数之比,而平衡浓度不一定等于系数之比,各组分浓度不随时间改变而改变才能说明达到平衡,故A错误;同一物质表示的正、逆反应速率相等,不同物质表示的正、逆反应速率之比等于化学方程式中对应系数之比时,都能说明反应达到平衡,v正(N2)/v逆(H2)=1/3,则3v正(N2)=v逆(H2),故B正确;合成氨是气体物质的量减小的反应,随着反应的进行,容器内混合气体的物质的量逐渐减小,则压强也逐渐减小,当混合气体总的物质的量保持不变或压强不变时,说明反应达到平衡,故C正确;由于各组分都是气体,因此混合气体的总质量始终不变,M=m/n=Mrg/mol,随着反应的进行,由于混合气体的总物质的量逐渐减小,则混合气体摩尔质量逐渐减小或相对分子质量逐渐减小,当混合气体物质的量不变或相对分子质量不变时,反应达到平衡,故D正确;N≡N键断裂、H—H键断裂都是正反应速率,故E错误;②由于氮气、氢气的起始物质的量未知,所以不能直接用定义式求氮气表示的速率,而氨气是生成物,起始时为0,则v(NH3)=
4NO
+ 6H2O;由于升高温度平衡向吸热方向移动,正反应是放热反应,则升高温度平衡向逆反应方向移动,则生成物浓度减小,反应物浓度增大,所以重新平衡时生成物浓度幂之积与反应物浓度幂之积的比值减小,即升高温度时该反应的平衡常数K减小;(2)先将4个热化学方程式分别编号为①②③④,由于①×2—②—③×4=④,根据盖斯定律,则④的焓变=①的焓变×2—②的焓变—③的焓变×4=(2a—b—4c)kJ/mol;(3)①容器内各组分浓度等于化学方程式的系数比,不能说明反应达到平衡,因为各组分变化浓度之比一定等于系数之比,而平衡浓度不一定等于系数之比,各组分浓度不随时间改变而改变才能说明达到平衡,故A错误;同一物质表示的正、逆反应速率相等,不同物质表示的正、逆反应速率之比等于化学方程式中对应系数之比时,都能说明反应达到平衡,v正(N2)/v逆(H2)=1/3,则3v正(N2)=v逆(H2),故B正确;合成氨是气体物质的量减小的反应,随着反应的进行,容器内混合气体的物质的量逐渐减小,则压强也逐渐减小,当混合气体总的物质的量保持不变或压强不变时,说明反应达到平衡,故C正确;由于各组分都是气体,因此混合气体的总质量始终不变,M=m/n=Mrg/mol,随着反应的进行,由于混合气体的总物质的量逐渐减小,则混合气体摩尔质量逐渐减小或相对分子质量逐渐减小,当混合气体物质的量不变或相对分子质量不变时,反应达到平衡,故D正确;N≡N键断裂、H—H键断裂都是正反应速率,故E错误;②由于氮气、氢气的起始物质的量未知,所以不能直接用定义式求氮气表示的速率,而氨气是生成物,起始时为0,则v(NH3)=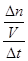 =
=
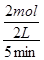 =0.2mol/(L•min);由于v(N2)/ v(NH3)=1/2,则v(N2)= 0.1mol/(L•min);设氮气、氢气的起始物质的量分别为xmol、ymol,则它们的起始浓度分别为x/2mol/L、y/2mol/L,则:
=0.2mol/(L•min);由于v(N2)/ v(NH3)=1/2,则v(N2)= 0.1mol/(L•min);设氮气、氢气的起始物质的量分别为xmol、ymol,则它们的起始浓度分别为x/2mol/L、y/2mol/L,则:
N2 + 3H2  2NH3
2NH3
起始浓度/ mol·L-1 x/2 y/2 0
变化浓度/ mol·L-1 1/2 3/2 1
平衡浓度/ mol·L-1 1/2 1/2 1
则x/2—1/2=1/2,y/2—3/2=1/2,解得:x=2,y=4
氢气的平衡转化率=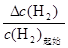 ×100%=
×100%=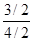 ×100%=75%。
×100%=75%。
画图要点:①t=0时,氨气浓度为0;t=5min,氨气浓度为1mol/L;0<t<5min时,氨气浓度逐渐增大;5min≤t<10min时,氨气浓度始终为1mol/L;②t=10min时,由于容器容积缩小1半,则反应物、生成物浓度立即增大一倍,则氨气浓度变为2mol/L;③缩小容器容积,就是增大压强,反应速率增大,达到平衡的时间大约是起始时达到平衡时间的一半,因此达到平衡的时间约为5/2min;若正反应能进行到底,氮气过量,4mol氢气最多可以生成8/3mol氨气,由于可逆反应不能进行到底,则浓度一定小于8/3mol/L≈2.67mol/L;10min<t≤12.5min时,由于正反应是气体体积减小的反应,增大压强平衡向正反应方向移动,所以氨气浓度从2mol/L逐渐增大到2.5mol/L左右;④12.5min<t≤15min时,氨气浓度始终为2.5mol/L左右。
考点:考查化学反应原理,涉及氨催化氧化的化学方程式、盖斯定律、化学平衡状态的标志、平均反应速率、平衡转化率、画出反应速率和化学平衡图像等。


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
| ||
| △ |
| ||
| △ |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| △ |
| ||
| △ |
| ||
| 高温高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:
(1)已知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式 。当温度升高时,化学平衡常数K值 (填“增大”、“减小”、“无影响”)。
(2)硝酸厂尾气常用的处理方法是:催化还原法:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol
N2(g)+2O2(g)=2NO2(g) △H=+67.7 kJ/mol
H2O(1)=H2O(g) △H=+44.0 kJ/mol
则8g H2恰好将NO2转化成N2和H2O(1)时△H= 。
(3)氨气是制取硝酸的重要原料,合成氨反应的化学方程式如下:N2+3H2![]() 2NH3,该反应在固定容积的密闭容器中进行。
2NH3,该反应在固定容积的密闭容器中进行。
①下列各项标志着该反应达到化学平衡状态的是 (填字母)。
A.容器内N2、H2、NH3的浓度之比为l:3:2
B.![]()
C.容器内压强保持不变
D.混合气体的密度保持不变
②若在恒温条件下,将N2与H2按一定比例混合通入一个容积为2 L固定容积的密闭容器中,5 min后反应达平衡时,n(N2)=1.2 mol,n(H2)=1.2 mol, n(NH3)=0.8mol,则反应速率v(N2)= ,平衡常数= (保留两位小数)。若保持容器的温度和容积不变,将上述平衡体系中的混合气体的浓度增大1倍,则平衡 (填向左、向右或不移动)移动。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省唐山市高三上学期期末统一考试理综试题化学试卷(解析版) 题型:选择题
(14分)工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:

(1)已知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式 。当温度升高时,化学平衡常数K值 (填“增大”、“减小”、“无影响”)。
(2)硝酸厂尾气常用的处理方法是:催化还原法:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol
N2(g)+2O2(g)=2NO2(g) △H=+67.7 kJ/mol
H2O(1)=H2O(g) △H=+44.0 kJ/mol
则8g H2恰好将NO2转化成N2和H2O(1)时△H= 。
(3)氨气是制取硝酸的重要原料,合成氨反应的化学方程式如下:N2+3H2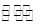 2NH3,该反应在固定容积的密闭容器中进行。
2NH3,该反应在固定容积的密闭容器中进行。
①下列各项标志着该反应达到化学平衡状态的是 (填字母)。
A.容器内N2、H2、NH3的浓度之比为l:3:2
B.
C.容器内压强保持不变
D.混合气体的密度保持不变
②若在恒温条件下,将N2与H2按一定比例混合通入一个容积为2 L固定容积的密闭容器中,5 min后反应达平衡时,n(N2)=1.2 mol,n(H2)=1.2 mol, n(NH3)=0.8 mol,则反应速率v(N2)= ,平衡常数= (保留两位小数)。若保持容器的温度和容积不变,将上述平衡体系中的混合气体的浓度增大1倍,则平衡 (填向左、向右或不移动)移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com