
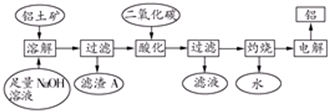
分析 铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,加入足量的氢氧化钠,氧化铝、二氧化硅与NaOH溶液反应均生成盐和水,只有氧化铁与碱不反应,结合信息②可知还生成Na2Al2Si2O8沉淀,过滤后得滤渣Fe2O3、Na2Al2Si2O8;滤液用二氧化碳酸化时,将NaAlO2完全转化为Al(OH)3,反应的离子方程式为:AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓;过滤得氢氧化铝沉淀,灼烧得氧化铝,电解氧化铝得单质铝,
(1)Al2O3是两性氢氧化物,SiO2是酸性氧化物,二者都与强碱反应生成盐和水;
(2)Al2O3、SiO2、Fe2O3用碱溶的方法分开.首先除掉不反应的Fe2O3,根据题中已知条件②除掉Na2SiO3.从而生成Na2Al2Si2O8,所以滤渣有两种.氧化物的形式是:金属氧化物•非金属氧化物•水,注意活泼金属氧化物写在前,注意原子个数的比例与原化学式中相同;
(3)通入二氧化碳酸化将NaAlO2转化成Al(OH)3,考查了氢氧化铝溶于强酸不溶于弱酸的知识;
(4)计算质量分数时用原子守恒法解,这是关系式:2Al~Al2O3,已知铝的质量,可算出铝的物质的量n(Al),再利用关系式算三氧化二铝的物质的量,n(Al2O3)=$\frac{1}{2}$n(Al),
Al2O3的质量为:m=n(Al2O3)•M(Al2O3),所以Al2O3的质量分数为Al2O3的质量除以铝土矿的总质量;
(5)铁、铝遇浓硫酸、浓硝酸会钝化,稀硝酸与铝反应产生有毒气体;
(6)在配合物中,内界是配位单元,含配位键,内界是复杂离子,外界是简单离子;配位原子是提供孤对电子的原子,配位数是配位原子的数目.
解答 解:铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,加入足量的氢氧化钠,氧化铝、二氧化硅与NaOH溶液反应均生成盐和水,只有氧化铁与碱不反应,结合信息②可知还生成Na2Al2Si2O8沉淀,过滤后得滤渣Fe2O3、Na2Al2Si2O8;滤液用二氧化碳酸化时,将NaAlO2完全转化为Al(OH)3,反应的离子方程式为:AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓;过滤得氢氧化铝沉淀,灼烧得氧化铝,电解氧化铝得单质铝,
(1)Al2O3是两性氢氧化物,SiO2是酸性氧化物,都要与强碱反应生成盐和水,反应的离子方程式为:,
故答案为:2OH-+Al2O3═2AlO2-+H2O、SiO2+2OH-═SiO32-+H2O;
(2)由于氢氧化钠是足量的,所以Al2O3和SiO2充分反应,生成Na2SiO3和NaAlO2,而铝土矿的主要成分是Al2O3,SiO2少量,那么生成的Na2SiO3少,NaAlO2多,
发生反应2Na2SiO3+2NaAlO2+4H2O═Na2Al2Si2O8↓+2H2O+4NaOH后,滤渣有之前不反应的Fe2O3和生成的Na2Al2Si2O8,滤液中有NaOH、余下大量的NaAlO2;
氧化物的形式为:金属氧化物•非金属氧化物•水,注意活泼金属氧化物写在前,则改写成氧化物的形式为:Na2O•Al2O3•2SiO2,
故答案为:Fe2O3;Na2Al2Si2O8、Na2O•Al2O3•2SiO2;
(3)从第2小题的分析可知滤液中的NaAlO2要转化成Al(OH)3不能用盐酸,盐酸是强酸,强酸过量后Al(OH)3会溶解,
故答案为:Al(OH)3溶于强酸而不溶于弱酸,提高Al2O3的提取率;
(4)已知铝nkg,可算出铝的物质的量,n(Al)=$\frac{1000ng}{27g/mol}$=$\frac{1000n}{27}$mol,根据原子守恒可得:2Al~Al2O3,则三氧化二铝的物质的量:n(Al2O3)=$\frac{1}{2}$n(Al),
n(Al2O3)=$\frac{500n}{27}$mol,所以Al2O3的质量为:m=n(Al2O3)•M(Al2O3)=$\frac{500n}{27}$mol×102 g•mol-1 =$\frac{51000n}{27}$ g,所以Al2O3的质量分数为:$\frac{\frac{51000n}{27}g}{1000mg}$×100%=$\frac{5100n}{27m}$%或$\frac{1700n}{9m}$%,
故答案为:$\frac{5100n}{27m}$%或$\frac{1700n}{9m}$%.
(5)因铝与浓硫酸在常温下发生钝化,加热溶解会产生有毒气体SO2,原料利用率低;稀硝酸能溶解铝但会产生NO气体,污染空气,硝酸利用率低;而铝与稀硫酸反应速率较快,产生的H2对空气无污染,则选稀硫酸溶解Al最好,
故答案为:B;
(6)在配合物中,内界是配位单元,含配位键,内界是复杂离子,外界是简单离子;配位原子是提供孤对电子的原子,配位数是配位原子的数目,这里的配位原子是氟原子,有6个,
故答案为:[AlF6]3-;6.
点评 本题考查制备方案的设计,涉及Al及其化合物的化学性质、物质分离提纯方法和基本操作的综合应用,题目难度中等,注意把握流程中发生的化学反应为解答的关键,注重信息与所学知识的结合分析解决问题,侧重知识迁移应用能力的考查.


科目:高中化学 来源: 题型:选择题
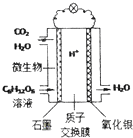 最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为H2O和CO2,同时产生电能,其原理示意如图.下列有关该电池的说法正确的是( )
最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为H2O和CO2,同时产生电能,其原理示意如图.下列有关该电池的说法正确的是( )| A. | 氧化银电极上反应为:Ag2O+2e-═2Ag+O2- | |
| B. | 石墨电极上反应为:C6H12O6+6H2O+24e-═6CO2↑+24H+ | |
| C. | 每转移4mol电子,氧化银电极产生22.4LCO2气体(标准状况) | |
| D. | 每30g C6H12O6参与反应,有4mo1 H+经质子交换膜进入正极区 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2 | B. | CO2 | C. | Cl2 | D. | O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 CH3COOCH2CH3+H2O,酯化(或取代)反应.
CH3COOCH2CH3+H2O,酯化(或取代)反应.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com