
(15分)铜是过渡金属元素,可以形成多种化合物。
(1)CuCl的盐酸溶液能够与CO发生反应:CuCl+CO+H2O=Cu(CO)Cl·H2O
①电负性:C ______O(填“>”或“=”或“<”)。②CO常温下为气体,固态时属于 晶体。
(2)Cu+与NH3形成的配合物可表示成[Cu(NH3)n]+,该配合物中,Cu+的4s轨道及4p通过sp杂化接受NH3提供的电子对。 [Cu(NH3) n]+ 中Cu+ 与n个氮原子的空间结构呈 型,n= 。
(3)CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):
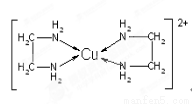
请回答下列问题:
①该配离子[Cu(En)2]2+中的中心原子的基态外围电子排布式为 。
②乙二胺分子中氮原子轨道的杂化类型为 ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是 。
③该配离子[Cu(En)2]2+中存在的作用力类型有 (填字母);
A配位键 B极性键 C离子键
D非极性键 E.氢键 F.金属键
(1)① < ② 分子 (2)直线形 2
(3)①3d9 ②sp3杂化 乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键 ③ABD
【解析】
试题分析:(1)①由于原子的比较C>O,元素的非金属性C<O。所以电负性:C<O。②CO常温下为气体,分子与分子之间通过分子间作用力结合形成分子晶体。因此在固态时属于分子晶体。(2)①在Cu+的4s轨道及4p通过sp杂化,是直线型的,所以[Cu(NH3) n]+ 中Cu+ 与n个氮原子的空间结构呈直线形,n=2。(3)①该配离子[Cu(En)2]2+中的中心原子Cu的基态外围电子排布式为3d9; ②乙二胺分子中氮原子轨道的杂化类型为sp3杂化; 乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键.增加了分子之间的相互作用,使物质气化消耗的分子间作用力大,需要的能量高,所以沸点高。③该配离子[Cu(En)2]2+中存在的作用力类型有A.N与Cu之间的配位键;B.N与H之间的极性键、C与H之间的极性键;D.C与C之间的非极性键。因此选项为A、B、D。
考点:考查元素的电负性、晶体的类型、化学键、原子的杂化方式、氢键、原子的电子排布式的知识。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源:2013-2014河南省濮阳市高二下学期升级考试化学试卷(解析版) 题型:填空题
【物质结构与性质】(15分)
根据元素周期表中第四周期元素的相关知识,回答下列问题:
(1)第四周期元素的基态原子的电子排布中4s轨道上只有1个电子的元素有_______种;
写出Cu+的核外电子排布式_________。
(2)按电子排布,可将周期表里的元素划分成五个区域,第四周期元素中属于s区的元素有___________种,属于d区的元素有________种。
(3)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为________;CaO的焰色反应为砖红色,许多金属或它们的化合物都可以发生焰色反应,其原因是________。

(4)由叠氮化钾(KN3)热分解可得纯 ,下列有关说法正确的是________(填选项字母)。
,下列有关说法正确的是________(填选项字母)。
A.NaN3与KN3结构类似,前者晶格能较小
B.晶体钾的晶胞结构如右图所示,每个晶胞中分摊2个钾原子
C.氮的第一电离能大于氧
D.氮气常温下很稳定,是因为氮的电负性小
(5)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂。O2在其催化作用下,可将CN-氧化成CNO-。CN-的电子式为________,CNO-的中心原子的杂化方式为____________。
(6)在CrCl3溶液中,一定条件下存在组成为 (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
将含0.0015mol 的溶液,与R-H完全交换后,中和生成的需浓度为
的溶液,与R-H完全交换后,中和生成的需浓度为
0.1200 mol/LNaOH溶液25.00 mL,则该配离子的化学式为____________。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省濮阳市高一下学期升级考试化学(A卷)试卷(解析版) 题型:实验题
在研究性学习中,用稀HNO3与Cu反应来制备NO气体。有两位学生设计了如图所示两个实验装置(a)和(b)。回答有关问题:
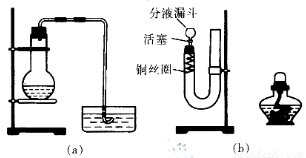
(1)写出铜与稀硝酸反应的化学方程式:________________________
(2)如果采用(a)装置,若加入20mL,6mol/LHNO3和2g薄铜片,在反应开始时,可观察到水槽内的导管中水面先慢慢上升到一定高度,此后又回落,然后有气泡从导管口冒出。试说明产生上述现象的原因:________。
(3)如果采用(b)装置,请将有关操作补充完全:
①将活塞打开,从U形管的长管口注入稀硝酸,一直注到__________为止。
②关闭活塞,用酒精灯在___________微热,当反应发生时,立即撤去酒精灯。
③反应在什么情况下可以自动停止?可以在何处观察到无色的NO气体?
____________________________________________________________.
④如果再将分液漏斗的活塞慢慢打开,可立即观察到哪明显现象?
____________________________________________________________.
⑤如果需再获得N0与已生成NO2的形成鲜明对照的实验效果,应___________(填操作)。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省濮阳市高一下学期升级考试化学(A卷)试卷(解析版) 题型:选择题
常用容量瓶的容积有
①50mL②75ml③l00mL④150mL⑤200mL⑥250mL⑦500mL⑧l000mL
A.①②⑥⑦ B.②④⑦⑧ C.①④⑥⑦ D.③⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省濮阳市高一下学期升级考试化学(A卷)试卷(解析版) 题型:选择题
电子云是用( )对核外电子运动规律所作的一种描述。
A.归纳的方法 B.统计的方法
C.照相法 D.叠加法
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省洛阳市高三年级第三次考试理综化学试卷(解析版) 题型:实验题
(15分)阿司匹林(乙酰水杨酸,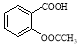 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的基本操作流程如下:

请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是 。
(2)写出制备阿司匹林的化学方程式 。
(3)反应过程中,要控制温度在85 ℃~90 ℃,其原因是 ,
应采用的加热方法是 。用这种方法加热需要的玻璃仪器有 。
(4)抽滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是 。
(5)如何检验产品中是否混有水杨酸? 。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省洛阳市高三年级第三次考试理综化学试卷(解析版) 题型:选择题
有机物X、Y、M的转化关系为: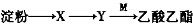 ,下列说法错误的是
,下列说法错误的是
A.X可用新制的氢氧化铜检验 B. Y有同分异构体
C. M含有两种碳氧共价键 D. Y可发生加成反应
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省洛阳市下学期期中考试高二化学试卷(解析版) 题型:填空题
(8分)某烃A的相对分子质量为84。回答下列问题:
(1)物质的量相同,下列物质充分燃烧与A消耗氧气的量不相等的是(填序号)_____________ 。
A. C7H12O2 B.C6H14 C.C6H14O D. C7H14O3
(2)若烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种。则A的结构简式为______________。
(3)若核磁共振氢谱显示链烃A有三组不同的峰,峰面积比为3:2:1,则A的名称为_____________。
(4)若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为_____________.
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列过程或现象与盐类水解无关的是
A.纯碱溶液去油污 B.加热稀醋酸溶液其pH 稍有减小
C.明矾净水 D.浓的硫化钠溶液有臭鸡蛋气味
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com