
元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下面是八种短周期元素的相关信息(已知铍的原子半径为0.089nm)
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
F原子中无中子,G最高正价数与负价数相等,且最外层电子数是次外层的二倍,H元素单质焰色反应呈黄色(用相应的元素符号完成下列空白)
(1)B元素在元素周期表中的位置___________________,上述八种元素的最高价氧化物对应的水化物中酸性最强的是__________.A离子的结构示意图_______________.
(2)用电子式表示A、D形成化合物的过程:______________________________.
H、E形成原子个数比为1:1的化合物的电子式为___________,含有的化学键类型为____________.C2D2的电子式为______________________.
(3)下列说法能说明D的非金属性比C强的选项____________
①H2CO4比HDO稳定②HDO4比H2CO4酸性强③C2-比D-易被氧化④HD比H2C稳定⑤铜与HD不反应,但能与浓H2CO4反应⑥铁与D2加热生成FeD3,铁与C加热生成FeC⑦C原子与D原子电子层数相同,D原子半径小于C原子。
A、全部 B、②③④⑥⑦ C、①②④⑤⑥ D、除①以外
(4)A、B、C、D、E形成的简单离子半径由大到小的顺序为_______________________。(用具体离子符号表示)
(5)C单质与H的最高价氧化物对应水化物在加热条件下能发生反应,若有3mol的C参与反应,转移4NA的电子,请写出离子反应方程__________________________氧化剂与还原剂的质量之比_____________________
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是




图Ⅰ 图Ⅱ 图Ⅲ 图Ⅳ
A.图Ⅰ配制1mol/LNaCl溶液定容操作 B.图Ⅱa口进气可收集Cl2、CO2等气体
C.图Ⅲ探究NaHCO3的热稳定性 D.图Ⅳ蒸发结晶获得氯化钠晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.用坩埚灼烧MgCl2·6H2O的反应式:
MgCl2·6H2O MgCl2+6H2O
MgCl2+6H2O
B.根据右表提供的数据,等物质的量浓度的NaClO、
NaHCO3混合溶液中,有c(HCO3-)>c(ClO-)>c(OH-) 。
C.常温下,将pH=2的稀硫酸稀释10倍,其中各离子的
物质的量浓度都变为原来的十分之一。
D.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,
溶度积常数CKsp=c(Ba2+)·c(SO42-)。则加入Na2SO4可使
 溶液由a点变到b点;通过蒸发可以使溶液由d 点变到c 点。
溶液由a点变到b点;通过蒸发可以使溶液由d 点变到c 点。
| 化学式 | 电离常数 |
| HClO | K1=3×10-8 |
| H2CO3 | K1=4.3×10-7[学*科 |
| K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述中正确的是( )
A、离子半径:C>D>B>A B、原子序数:d>c>b>a
C、原子半径:A>B>C>D D、单质的还原性:A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中进行如下反应:2SO2(气)+O2(气) 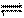 2SO3(气),已知反应过程
2SO3(气),已知反应过程
中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是 ( )
A、SO2为0.4mol/L、O2为0.2mol/L B、SO2、SO3均为0.15mol/L
C、SO2为0.25mol/L D、SO3为0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
有关下列叙述不正确的是
A. 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应
B.干馏煤可以得到甲烷、苯和氨等重要化工原料
C.用于奥运“祥云”火炬的丙烷是一种清洁燃料
D.油脂的皂化反应生成高级脂肪酸钠和丙三醇
查看答案和解析>>
科目:高中化学 来源: 题型:
每年夏季,农民焚烧植物秸秆(主要成分是纤维素),既污染了环境,又浪费了资源,工业上以植物秸秆为原料合成某聚酯化合物的路线如下:

已知A是常见的消毒剂,又可作为能源。
(1)乙烯中官能团的结构式为___________;葡萄糖分子中官能团的电子式为_________________________;
(2)由B转化为C的反应条件是________________;C转化为D的反应类型是___________;
(3)测定D中所含官能团的物理方法是______________;若B是氯代烃,其系统命名法的名称是__________________;
(4)写出下列反应方程式:
A:由植物秸秆转化成葡萄糖________________________________________________
B:由A转化成乙烯__________________________________________________
C:生成聚酯化合物__________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y是第二或第三周期的同周期元素,它们可以形成离子化合物XmYn,且离子均具有稀有气体的电子层结构,若X的原子序数为a,则Y的原子序数可能是 ( )
A.a+8-m-n B.a+16-m-n C.a-m-n D.a-8+m+n
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com