
【题目】下列电子排布图所表示的元素原子中,其能量处于最低状态的是 ( )

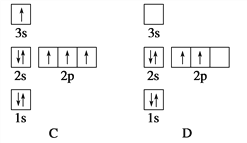
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】某化学实验小组用下图装置制取、收集纯净干燥的氨气,并探究氨气的有关性质。
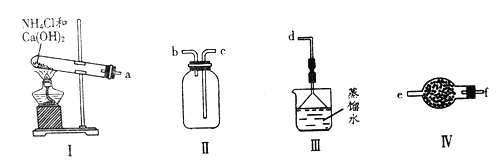
回答下列问题:
(1)写出利用装置I制取氨气的化学方程式_________________________________。
(2)按照气流方向,仪器连接的顺序:a→___________________________→d(用字母编号表示)。
(3)实验中装置III的作用________________。
(4)装置IV中仪器的名称为________,盛装的试剂为______________。
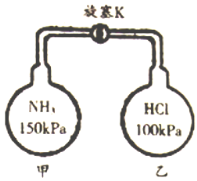
(5)在甲、乙玻璃容器中分别收集氨气和氯化氢,按下图装置进行实验。打开旋塞K,观察到的实验现象是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中发生反应2A2(g)+B2(g)![]() 2C(g) △H=—a kJ/mol(a>0),已知P是可自由滑动的活塞。在相同温度进关闭K,向A、B容器中分别充入2molA2和1molB2,两容器分别在500℃时达到平衡,A中C的浓度为
2C(g) △H=—a kJ/mol(a>0),已知P是可自由滑动的活塞。在相同温度进关闭K,向A、B容器中分别充入2molA2和1molB2,两容器分别在500℃时达到平衡,A中C的浓度为![]() mol/L,放出热量b kJ,B中C的浓度分别为
mol/L,放出热量b kJ,B中C的浓度分别为![]() mol/L,放出热量c kJ。请回答下列问题:
mol/L,放出热量c kJ。请回答下列问题:

(1)若将温度升高到700℃,反应的平衡常数将_____(填“增大”、“减小”、或“不变”)。
(2)比较大小: ![]() _____
_____![]() (填“>”、“=”、或“<”),a、b、c由大到小的关系为_____。
(填“>”、“=”、或“<”),a、b、c由大到小的关系为_____。
(3)若打开K,一段时间后重新达到平衡,容器B的体积将_____(填“增大”、“减小”、或“不变”)。
(4)若让A、B体积相等且固定P,在B中改充入4 molA2和2 molB2,在500℃时达到平衡后C的浓度为![]() mol/L,则
mol/L,则![]() 、
、![]() 的关系为_____。
的关系为_____。
(5)能说明A中已达到平衡状态的是_____(填序号,有一个或多个选项符合题意)。
a. ![]() (C)=2
(C)=2![]() (B2) b. 容器内气体压强保持不变
(B2) b. 容器内气体压强保持不变
c. 容器中气体的平均相对分子质量不随时间而变化 d. 容器内的气体密度保持不变
(6)使该反应的反应速率增大,且平衡向正反应方向移动的是_____。
a.及时分离出C气体 b. 适当升高温度 c. 增大B2的浓度 d. 选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F、G七种元素,除E为第四周期元素外其余均为短周期元素。A、E、G位于元素周期表的s区,其余元素位于p区,A、E的原子外围电子层排布相同,A的原子中没有成对电子;B元素基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;C元素原子的外围电子层排布式为nsnnpn+1;D元素单质的氧化性在同周期主族元素的单质中排第二位;F的基态原子核外成对电子数是单电子数的3倍;G的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。回答下列问题:
(1)写出下列元素的符号:D________,G________。
(2)E元素位于周期表________区,________族。
(3)写出C的电子排布式:________。
(4)B的原子结构示意图为________。
(5)基态A原子中含有的未成对电子数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素原子的电子排布式为[Ar]3d104s24p1,根据原子核外电子排布与元素在元素周期表中的位置关系,完成下列各题:
(1)该元素处于元素周期表的第________周期,该周期的元素种数是________;
(2)该元素处于元素周期表的第________族,该族的非金属元素种数是________;
(3)该元素处于元素周期表的________区,该区包括________族的元素。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解NaB(OH)4溶液制备H3BO3的原理如下图所示,下列叙述错误的是

A. M室发生的电极反应式:2H2O-4e-=O2↑+4H+
B. a、c为阴离子交换膜,b为阳离子交换膜
C. N室中:a%<b%
D. 理论上每生成1 mol H3BO3,两极室共产生标准状况下16.8 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X和Y是原子序数大于4的短周期元素, ![]() 、
、![]() 两种离子的核外电子排布相同。下列说法中正确的是 ( )
两种离子的核外电子排布相同。下列说法中正确的是 ( )
A. X的原子半径比Y的原子半径小 B. X和Y的核电荷数之差为m -- n
C. Y原子核内所含质子数比X多 D. ![]() 半径比
半径比![]() 小
小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究二氧化硫的性质,按如图所示装置进行实验。

请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是__________,反应的化学方程式为_______________。
(2)装置B中的现象是__________________,反应的离子方程式为_________________。
(3)装置C中的现象是____________________,该现象说明二氧化硫具有的性质是________________________。
(4)装置D的目的是探究二氧化硫与品红作用的可逆性,写出实验操作及现象_____________。
(5)尾气可采用__________溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铝元素的叙述正确的是
A. 铝片加入烧碱溶液中有氢气生成
B. 铝锅煮水有大量氢气生成
C. 铝在空气中生成一层氧化物薄膜,从而光泽更好
D. 浓硫酸越浓,与铝反应越剧烈
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com