
|
| 1×10-14 |
| 10-9 |


科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.4×10-6 mol/L | B.2.3×10-6 mol/L |
| C.1.4×10-9 mol/L | D.2.3×10-9 mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.RCl>RI>R2CrO4 | B.RCl>R2CrO4>RI |
| C.R2CrO4>RCl>RI | D.R2CrO4>RI>RCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.25℃时,0.1mol?L-1HF溶液中pH=1 | ||
| B.Ksp(CaF2)随温度和浓度的变化而变化 | ||
C.该体系中Ksp(CaF2)=
| ||
| D.该体系中有CaF2沉淀产生 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等体积混合浓度均为0.2mol?L-1的AgNO3溶液和CH3COONa溶液一定不产生CH3COOAg沉淀 |
| B.将0.001mol?L-1的AgNO3溶液滴入0.001mol?L-1的KCl和0.001mol?L-1的K2CrO4溶液中先产生Ag2CrO4沉淀 |
| C.在Mg2+为0.12mol?L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH至少要控制在9以上 |
| D.向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)变大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.x的数值为2×10-5 |
| B.c点时有碳酸钙沉淀生成 |
| C.b点与d点对应的溶度积相等 |
| D.加入蒸馏水可使溶液由d点变到a点 |
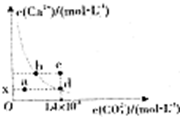
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 电极反应式 | 出现环境 | |
| A | H2-2e-=2H+ | 碱性环境下氢氧燃料电池的负极反应 |
| B | 4OH--4e-=O2↑+2H2O | 中性环境下钢铁的吸氧腐蚀 |
| C | 2H++2e-=H2↑ | 用Cu作电极电解NaOH溶液的阴极反应 |
| D | H2-2e-=2H+ | 用惰性电极电解H2SO4的阳极反应 |
| A.A | B.B | C.C | D.D |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.电池内部含有电解质 | B.锌是负极,碳棒是正极 |
| C.电池用完后可埋入土壤 | D.锌锰干电池属一次电池 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com