
| A. | NaOH | B. | FeCl3 | C. | Na2CO3 | D. | Ca(OH)2 |
分析 除去溶液中的Mg2+和Ca2+,可分别生成Mg(OH)2和CaCO3沉淀,可加入NaOH,据此解题.
解答 解:A.加入氢氧化钠,可生成氢氧化镁和碳酸钙沉淀,可用于除杂,故A正确;
B.加入FeCl3,不能除掉氯化钙和镁离子,故B错误;
C.加入Na2CO3,与氯化钙反应生成碳酸钙沉淀,与Mg(HCO3)2不反应,不能除去杂质,故C错误;
D.加入Ca(OH)2,最终生成氯化钙,不能完全除去沉淀,故D错误.
故选A.
点评 本题考查物质的分离、提纯和除杂等问题,题目难度不大,根据除杂是不能引入新的杂质、不能影响被提纯的物质的性质和量,并且操作简单可行,除杂时要结合物质的物理性质和化学性质进行分离.


科目:高中化学 来源: 题型:选择题
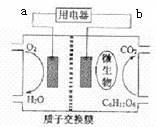
| A. | 微生物促进了反应中电子的转移 | |
| B. | 连接a的电极为负极 | |
| C. | 放电过程中,质子(H+)从负极区向正极区迁移 | |
| D. | 电池的负极反应为:C6H12O6+6H2O-24e-═6CO2+24H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由此反应可知:还原性HCl>CrCl3 | |
| B. | 每产生3mol Cl2,实际投入的盐酸要大于14mol | |
| C. | 氧化剂和还原剂的物质的量之比为1:6 | |
| D. | 当转移0.3mol电子时,被氧化的还原剂的物质的量为0.7mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 是a mL | B. | 是(50-a)mL | C. | 一定大于a mL | D. | 一定大于(50-a)mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①②④ | C. | ①④⑤ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com