
| A. | Na+、Al3+、HCO3-、NO3- | B. | Fe3+、SCN-、Cl-、K+ | ||
| C. | NH4+、Na+、CH3COO-、NO3- | D. | Na+、NO3-、ClO-、I- |
科目:高中化学 来源: 题型:选择题
| A. | 在任何温度下都能自发进行 | B. | 在任何温度下都不能自发进行 | ||
| C. | 仅在高温下自发进行 | D. | 仅在低温下自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
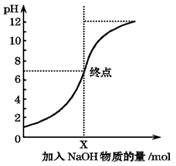 如图是室温下,向100mL盐酸中逐渐加入NaOH溶液时,溶液的pH变化图象.根据图象所得结论正确的是( )
如图是室温下,向100mL盐酸中逐渐加入NaOH溶液时,溶液的pH变化图象.根据图象所得结论正确的是( )| A. | 原来盐酸的物质的量浓度为0.1mol/L | |
| B. | NaOH溶液的浓度为0.1mol/L | |
| C. | pH=1和pH=7的点对应溶液中水的电离程度相同 | |
| D. | X点NaOH溶液的体积为100mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将浓硫酸转移至容量瓶中,加水稀释至距标线2~3 cm处,改用胶头滴管定容 | |
| B. | 用酒精萃取碘水中的碘单质 | |
| C. | 进行液体蒸馏实验时,冷凝管中应充满自来水 | |
| D. | 某溶液加入盐酸酸化的氯化钡溶液后,出现白色沉淀,则原溶液中必有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
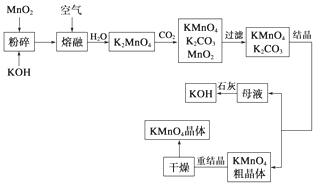
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 | B. | 50 | C. | 5×l03 | D. | 104 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 运用蒸馏的方法,可以分离沸点相差较大的固体混合物 | |
| B. | 铁的化合物应用十分广泛,如FeCl3、FeSO4是优良的净水剂 | |
| C. | 镁燃烧发出耀眼的白光,常用于制造信号弹和焰火 | |
| D. | 工业上以氯气和石灰乳为原料制造漂白粉,漂白粉主要成分为Ca(ClO)2和CaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 室温下,将1.000mol•L-1盐酸滴入20.00 mL 1.000mol•L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示.下列有关说法中不正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00 mL 1.000mol•L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示.下列有关说法中不正确的是( )| A. | a点:由水电离出的c(H+)>1.0×10-14mol/L | |
| B. | b点:c(NH4+)+c(NH3•H2O)>c(Cl-) | |
| C. | c点:c(Cl-)<c(NH4+) | |
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com