
已知,A为空气中含量最多的单质。根据下图转化关系,回答下列问题:
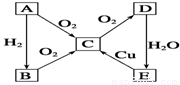
(1)写出下列物质的化学式:
A 、D 。
(2)E→C的反应方程式为 。
(3)久置的E的浓溶液常常呈黄色,原因是 。
(4)实验室制取B的化学方程式为____________________________________。
(5)现有1.00mol·L-1的E溶液,从中取出10.00 mL。此10.00 mL溶液的物质的量浓度为 mol·L-1。将前面取出的E溶液配制成0.100mol·L-1的稀溶液,所需的玻璃仪器除烧杯、玻璃棒外,还需 和 。在配制过程中定容时俯视,则所配溶液浓度 (填“偏大”或“偏小”或“无影响”)。
(1)N2 NO2(每空1分,共2分)
(2)3Cu + 8HNO3 = 3Cu(NO)3 + 2NO↑+ 4H2O(2分)
(3)硝酸分解产生NO2溶解在硝酸中(2分)
(4)2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑+ 2H2O(2分)
(5)1.00 100毫升容量瓶 胶头滴管 偏大(每空1分,共4分)
【解析】
试题分析:分析:当A为空气中含量最高的单质气体时,应为N2,则C为NO,B为NH3,D为NO2,E为HNO3;(1)写出下列物质的化学式:A、N2;NO2;答案:N2 NO2;(2)E→C的反应方程式为3Cu + 8HNO3 = 3Cu(NO)3 + 2NO↑+ 4H2O,答案:3Cu + 8HNO3 = 3Cu(NO)3 + 2NO↑+ 4H2O;(3)E为HNO3,久置的E的浓溶液常常呈黄色,原因是硝酸分解产生NO2溶解在硝酸中,答案:硝酸分解产生NO2溶解在硝酸中;(4)B为NH3,实验室制取B的化学方程式为2NH4Cl
+ Ca(OH)2  CaCl2 + 2NH3↑+ 2H2O,答案:2NH4Cl + Ca(OH)2
CaCl2 + 2NH3↑+ 2H2O,答案:2NH4Cl + Ca(OH)2  CaCl2 + 2NH3↑+ 2H2O;
CaCl2 + 2NH3↑+ 2H2O;
⑸溶液有均一性和稳定性,E为HNO3,1.00mol·L-1的E溶液,从中取出10.00 mL。此10.00 mL溶液的物质的量浓度为 1.00mol·L-1,将前面取出的E溶液配制成0.100mol·L-1的稀溶液,所需的玻璃仪器除烧杯、玻璃棒外,还需100毫升容量瓶和胶头滴管,在配制过程中定容时俯视,定容体积偏小,则所配溶液浓度偏大。 答案:1.00 100毫升容量瓶 胶头滴管 偏大
考点:无机推断,溶液的配制


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
 NH3?H2O
NH3?H2O NH4++OH-
NH4++OH- NH3?H2O
NH3?H2O NH4++OH-
NH4++OH-
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
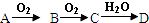
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com