
现有下列四种因素:① 温度和压强 ② 所含微粒数 ③ 微粒本身大小 ④ 微粒间的距离,其中对气体物质体积有显著影响的是
A、只②③④ B、只①②④ C、只①③④ D、①②③④全部
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源:2016届江苏省高三上学期第三次月考化学试卷(解析版) 题型:选择题
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项 | 实验操作 | 现象 | 结论 |
A | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe氧化为Fe3+ |
B | 分别加热Na2CO3和NaHCO3固体 | 试管内壁都有水珠 | 两种物质均受热分解 |
C | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 铝不能熔化 | 金属铝的熔点较高 |
D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,震荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二上第一阶段测化学试卷(解析版) 题型:选择题
将0.1 mol·L-1的氨水加水稀释至0.01 mol·L-1,稀释过程中温度不变,下列叙述正确的是
A.稀释后溶液中所有离子的浓度均减小
B.稀释后溶液中c(OH-)小于稀释前的1/10
C.稀释过程中氨水的电离平衡向左移动
D.稀释过程中溶液中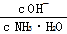 增大
增大
查看答案和解析>>
科目:高中化学 来源:2016届山东省滕州市高三上学期10月月考化学试卷(解析版) 题型:选择题
依据氧化还原反应:Cu2+(aq)+Fe(s)= Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是
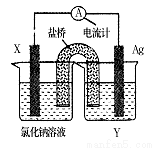
A.电极X的材料是Fe
B.电解质溶液Y是AgNO3溶液
C.原电池工作时,X电极反应为:O2+2H2O+4e- =4OH-
D.原电池工作时,盐桥中的阴离子不断移向左池的氯化钠溶液中
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上10月月考化学试卷(解析版) 题型:填空题
(8分)有一固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、CuCl2、Ba(NO3)2、K2CO3、K2SO4中的一种或几种,现按下列步骤进行实验。
(1)将该粉末溶于水得无色溶液和白色沉淀。
(2)在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,同时产生无色气体。
(3)取滤液做焰色反应,可证明滤液中含Na+,不含K+。
由上述现象推断:
(1)该混合物中一定含有 ;一定不含有 ,可能含有 。
(2)如要检验可能含有的物质是否存在,将如何操作
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃兰州一中高二上期中测试理科化学试卷(解析版) 题型:填空题
(10分)FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小。请回答下列问题:
(1)FeCl3 净水的原理是 。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3 氧化酸性FeCl2 废液得到FeCl3。
①若酸性FeCl2 废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+)=1.0×10-3mol·L-1, c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为 。
②完成NaClO3 氧化FeCl2 的离子方程式:_____ClO3-+______Fe2++______ =_____Cl-+_____Fe3++______
(3)FeCl3 在溶液中分三步水解:Fe3++H2O Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2 Fe(OH)++H2O
Fe(OH)2++H+ K2 Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:
xFe3++yH2O Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号) 。
Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃兰州一中高二上期中测试理科化学试卷(解析版) 题型:选择题
下图曲线a表示放热反应X(g)+Y(g) Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
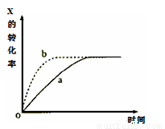
A.减小体积 B.加大X的投入量
C.减压 D.升高温度
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三上学期第二次月考理综化学试卷(解析版) 题型:选择题
控制适当的条件,将反应Fe3++Ag=Fe2++Ag+设计成如图所示的原电池(盐桥装有琼脂-硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)。已知接通后观察到电流计指针向右偏转。下列判断正确的是
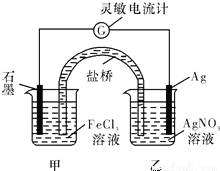
A.在外电路中,电子从石墨电极流向银电极
B.盐桥中的K+移向乙烧杯
C.一段时间后,电流计指针反向偏转,越过0刻度,向左边偏转
D.电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
下列有关Fe2(SO4)3溶液的叙述正确的是
A.该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存
B.和KI溶液反应的离子方程式:Fe3+ + 2I- Fe2+ + I2
Fe2+ + I2
C.和Ba(OH)2溶液反应的离子方程式:Fe3+ + SO42- + Ba2+ + 3OH- Fe(OH)3↓+ BaSO4↓
Fe(OH)3↓+ BaSO4↓
D.1L0.1mol/该溶液和足量的Zn充分反应,生成11.2gFe
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com