
(9分)(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g) + 3H2O(1) 2NH3(g) +
2NH3(g) + 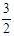 O2(g) ;△H =" a" kJ·mol—1
O2(g) ;△H =" a" kJ·mol—1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
 2NH3(g) ΔH= -92.4kJ·mol—1
2NH3(g) ΔH= -92.4kJ·mol—1 2H2O(l) ΔH = -571.6kJ·mol—1
2H2O(l) ΔH = -571.6kJ·mol—1科目:高中化学 来源: 题型:
| 2 |
| 3 |
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源:2011届山东省日照市高三第一次模拟考试(理综)化学部分 题型:填空题
(14分)I.科学家一直致力于“人工固氮”的新方法研究。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2 (g)+6H2O(l) 4NH3 (g)+3O2 (g) ΔH=a kJ·mol-1
4NH3 (g)+3O2 (g) ΔH=a kJ·mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| 温度T/K | 303 | 313 | 323 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
 ”“<”或“=”)
”“<”或“=”) 2NH3 (g) ΔH=-92.4kJ·mol-1,
2NH3 (g) ΔH=-92.4kJ·mol-1, 4NH3 (g) + 3O2 (g) ΔH= ;
4NH3 (g) + 3O2 (g) ΔH= ;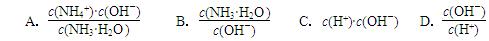
 2SO3 (g) ΔH=-196.0kJ·mol-1
2SO3 (g) ΔH=-196.0kJ·mol-1| A.加入V2O5作催化剂 | B.使用过量SO2 | C.高温 | D.通入过量空气 |
查看答案和解析>>
科目:高中化学 来源:2013届福建省高二下学期期中考试化学试卷(解析版) 题型:填空题
(9分)(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g) + 3H2O(1)  2NH3(g) +
2NH3(g) + 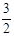 O2(g)
;△H = a kJ·mol—1
O2(g)
;△H = a kJ·mol—1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
|
T/K |
303 |
313 |
323 |
|
NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
①此合成反应的a 0;ΔS 0,(填“>”、“<”或“=”)
②已知:N2(g) + 3H2(g) 2NH3(g) ΔH= -92.4kJ·mol—1
2NH3(g) ΔH= -92.4kJ·mol—1
2H2(g) + O2(g) 2H2O(l)
ΔH = -571.6kJ·mol—1
2H2O(l)
ΔH = -571.6kJ·mol—1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:
(2)①已知:0.5mol液态肼(N2H4)与足量的液态双氧水反应生成氮气和水蒸气,放出256kJ的热量,写出该反应的热化学方程式
②又已知H2O(g)=H2O(l) △H=-44kJ•mol-1。则32g液态肼与足量的液态双氧水反应生成氮气和液态水时放出的热量是 kJ
③此反应用于火箭推进,除释放大量热和快速产生大量气体外还有一个很大优点是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com