
分析 烷烃的一氯取代物有两种,说明该烷烃中有两种等效氢原子,根据等效氢原子的判断方法来回答;
根据烷烃的命名原则分析进行命名:碳链最长称某烷,靠近支链把号编.简单在前同相并,其间应划一短线,
1、碳链最长称某烷:选定分子里最长的碳链做主链,并按主链上碳原子数目称为“某烷”,
2、靠近支链把号编:把主链里离支链较近的一端作为起点,用1、2、3…等数字给主链的各碳原子编号定位以确定支链的位置,
3、简单在前同相并,其间应划一短线:把取代基的名称写在烷烃名称的前面,在取代基的前面用阿拉伯数字注明它在烷烃主链上的位置,而且简单的取代基要写在复杂的取代基前面,如果有相同的取代基,则要合并起来用二、三等数字表示,但是表示相同的取代基位置的阿拉伯数字要用逗号隔开,并在号数后面连一短线,中间用“-“隔开.
解答 解:烷烃分子中,同一个碳上的氢原子等效,连在同一个碳原子上的氢原子等效,具有镜面对称的碳原子上的氢原子等效,烷烃的一氯取代物有两种,说明该烷烃中有两种等效氢原子,丁烷结构简式为:CH3CH2CH2CH3,丁烷的一氯代物有两种,用两个甲基分别取代丁烷分子中的2、3号碳上1个H,得到的有机物的结构简式为:(CH3)2CHCH(CH3)2,满足题干中分子中有六个碳原子和四个甲基且一氯代物有两种的烷烃的条件,主链最长的碳链含有4个C,称为丁烷;编号从左边或右边开始(因分子结构对称),在2号C上、3号碳上各有一个甲基,所以该有机物命名为:2,3-二甲基丁烷,
故答案为:(CH3)2CHCH(CH3)2;2,3-二甲基丁烷.
点评 本题考查学生同分异构体的概念和应用知识、烷烃的命名,要求学生具有整合知识的能力,注意等效氢的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用盐酸洗涤过滤 | B. | 用加热还原 | ||
| C. | 用CO加热还原 | D. | 用NaOH溶液洗涤,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
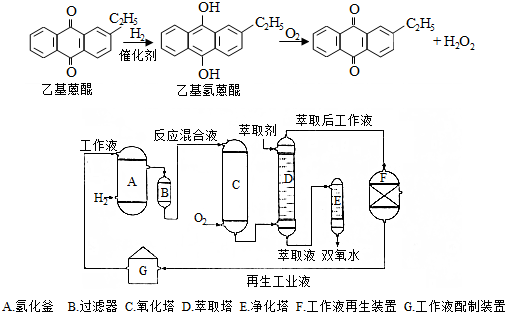
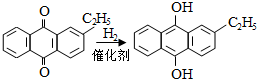 .进入氧化塔C的反应混合液中的主要溶质为乙基氢蒽醌.
.进入氧化塔C的反应混合液中的主要溶质为乙基氢蒽醌.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
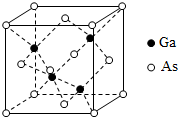 砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等.回答下列问题:
砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,测得氯化铵溶液pH<7,证明一水合氨是碱:NH4++2H2O═NH3•H2O+H3O+ | |
| B. | 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | 用碳酸氢钠溶液检验水杨酸中的羧基: +2HCO3-→ +2HCO3-→ +2H2O+2CO2↑ +2H2O+2CO2↑ | |
| D. | 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-═2Mn2++10CO2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢能将是二十一世纪的重要能源,推广应用氢能最关键技术是高容量储氢材料的研制 | |
| B. | 纳米TiO2光触媒技术制成的“木地板精油”能将水气转化为活性氧,由此可推测TiO2光触媒技术制成的“木地板精油可以有效降解甲醛、苯、氨等居室污染物 | |
| C. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强酸、强碱都会“断路” | |
| D. | 门捷列夫提出的元素周期律为发现新元素、合成新材料提供了新思路 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com