
【题目】某冶炼厂利用炼铜产生的SO2生产硫酸,变废为宝,化害为利。其原理是
A.利用了SO2的水溶性,将SO2直接通入水中
B.利用了SO2的氧化性,将SO2直接通入水中
C.利用了SO2的氧化性,使其与O2反应而转化为SO3,再与水反应
D.利用了SO2的还原性,使其与O2反应而转化为SO3,再与水反应
科目:高中化学 来源: 题型:
【题目】有人设计了如图所示实验,以确认某混合气体中含有C2H4和SO2 . 混合气体,所需试剂有:
A.品红溶液 B.NaOH溶液
C.浓H2SO4 D.酸性高锰酸钾溶液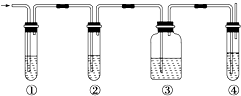
试回答下列问题:
(1)写出图中①、②、③、④装置可盛放的试剂(将上述有关试剂的序号填入空格内): ① , ② , ③ , ④ .
(2)使用装置②的目的是 .
(3)写出SO2与酸性高锰酸钾反应的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:。
(2)写出“联合制碱法”有关反应的化学方程式:。
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应列出计原子利用率的表达式:原子利用率(%)?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取SO2的反应原理为:Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O.请用下列装置设计一个实验,以测定SO2转化为SO3的转化率: 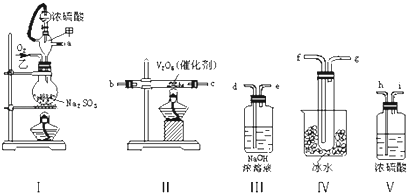
(1)这些装置的连接顺序(按气体左右的方向)是→→→→→→→(填各接口的编号).
(2)实验时甲仪器橡胶支管的作用与原理是 .
(3)从乙处均匀通入O2 , 为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 .
(4)Ⅳ处观察到的现象是 .
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会(填“增大”“不变”或“减小”).
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g) ![]() 4NO+6H2O在2L的密闭容器中进行,30s后NO的物质的量增加了0.30mol.下列说法正确的是( )
4NO+6H2O在2L的密闭容器中进行,30s后NO的物质的量增加了0.30mol.下列说法正确的是( )
A.容器中NH3的物质的量一定增加了0.30mol
B.容器中H2O(g)的物质的量至少为0.45mol
C.NH3的平均反应速率为0.010mol/(Ls)
D.NH3、O2、NO、H2O的物质的量之比一定为4:5:4:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨所用的H2可由煤与水反应制得,其中有一步反应为CO(g)+H2O(g) ![]() CO2(g)+H2(g),ΔH<0,欲提高CO转化率可采用的方法有:①降低温度;②增加压强;③使用催化剂;④增大CO的浓度;⑤增大水蒸气的浓度,其中正确的组合是( )
CO2(g)+H2(g),ΔH<0,欲提高CO转化率可采用的方法有:①降低温度;②增加压强;③使用催化剂;④增大CO的浓度;⑤增大水蒸气的浓度,其中正确的组合是( )
A.①②③④⑤
B.①⑤
C.①④⑤
D.只有⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】市场上有一种用于预防和治疗缺氧症状的便携式制氧器,利用过碳酸钠固体A(化学式为2Na2CO33H2O2)和灰黑色固体B(不溶于水)与水混合反应制得氧气.某同学对A、B两种物质进行探究,实验步骤及现象如下图所示.下列说法 错误的是( )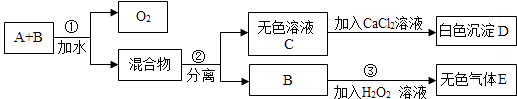
A.物质B在反应①中可能起催化作用
B.设计③的目的是制取氧气
C.第②步分离混合物的方法是过滤
D.白色沉淀D为CaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于元素周期表的说法正确的是( )
A.元素周期表中有8个主族
B.元素周期表中有7个周期
C.周期表中的主族都有金属元素
D.IA族中的元素全部是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,反应4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H=﹣a kJ/mol,在5L密闭容器中进行,10s时,水蒸气的物质的量增加了0.60mol,则下列说法不正确的是( )
A.10s内,NH3的平均反应速率为0.008molL﹣1s﹣1
B.该反应达到平衡时6v(O2)正=5v(H2O)逆
C.10s内,反应放出的热量为0.1akJ
D.10s时,H2O的反应速率为0.012molL﹣1s﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com