
【题目】下列叙述中,属于糖类作用的是( )
A. 良好的溶剂 B. 主要的能源物质
C. 良好的储能物质 D. 携带遗传信息的物质
科目:高中化学 来源: 题型:
【题目】下列物质在元素组成上最相似的一组是( )
A. 糖原、胰岛素、性激素 B. 纤维素、性激素、抗体
C. 葡萄糖、脱氧核糖、核糖核酸 D. 磷脂、DNA、RNA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读、分析下列两个材料:
材料一:如图
材料二:如表
物质 | 熔点/℃ | 沸点/℃ | 密度/gcm﹣3 | 溶解性 |
乙二醇C2H6O2 | ﹣11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇C3H8O3 | 17.9 | 290 | 1.26 | 跟水、酒精以任意比互溶 |
根据上述材料及课本知识,回答下列问题(每空只填一个字母选项,):
A.蒸馏法 B.萃取法 C.“溶解、结晶、过滤”的方法 D.分液法
(1)分离汽油和水的最佳方法是;
(2)去除纯碱中的少量氯化钠杂质,最好应用;
(3)将乙二醇和丙三醇相互分离的最佳方法是 . 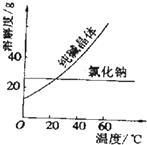
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中能够大量共存的是( )
A.Na+、Fe2+、H+、NO3-
B.Na+、H+、Cu2+、NO3-
C.NH4+、Cl-、SO42-、OH-
D.HCO3-、NH4+、Na+、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有色金属行业发展蕴藏着巨大潜力。目前,全世界消费量排在前五位的为铜、铝、铅、锌、镍。回答下列问题。
(1)铜原子的电子占有________种能量不同的原子轨道;在元素周期表中铝和铅元素处于周期表的_____区。
(2)配合物分子内(如图)的化学键有____________(填序号)。

A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH![]() CH、③苯、④HCHO等,其中分子中C原子为sp杂化的有___________(填物质序号);预测σ键与π键比值为3∶1的分子的立体结构为_______________形。
CH、③苯、④HCHO等,其中分子中C原子为sp杂化的有___________(填物质序号);预测σ键与π键比值为3∶1的分子的立体结构为_______________形。
(4)硫酸锌是最重要的锌盐,为无色斜方晶体或白色粉末,其七水合物(ZnSO4·7H2O) 俗称皓矾,是一种天然矿物。请在SO42-的立体结构图(如图)中,描画出氧原子(用实心圆点“![]() ”表示)和硫原子(用空心圆点“O”表示)的位置。_____________
”表示)和硫原子(用空心圆点“O”表示)的位置。_____________

(5)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。
①下列关于该贮氢材料及氢气的说法,正确的是__________(填序号)。
A.该材料中镧原子和镍原子之间存在化学键,是原子晶体
B.已知镧和镍的第一电离能分别为5.58eV、7.64eV,可见气态镧原子比气态镍原子更容易变成+1价的气态阳离子
C.氢分子被吸收时首先要在合金表面解离变成氢原子,同时放出热量
D.该材料贮氢时采用常温高压比采用常温常压更好
E.氢气很难液化是因为虽然其分子内氢键很强,但其分子间作用力很弱
②该合金的晶胞如图所示,属六方晶系,底面夹角为60°(120°),经测定晶胞参数a=511pm,c=397pm,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上,该晶体的化学式为_______________。若每个晶胞可吸收3个H2,则储氢后(氢进入晶胞空隙,体积不变)该晶胞的密度计算式为___________________________。(NA表示阿伏加德罗常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关. 已知:H2(g)+Cl2(g)═2HCl(g)△H=﹣185kJ/mol
E(H﹣H)=436kJ/mol,E(Cl﹣Cl)=243kJ/mol
则E(H﹣Cl)= .
(2)纳米级Cu2O由于具有优良的催化性能而受到关注.已知: 2Cu(s)+ ![]() O2(g)═Cu2O(s)△H=﹣169kJmol﹣1 ,
O2(g)═Cu2O(s)△H=﹣169kJmol﹣1 ,
C(s)+ ![]() O2(g)═CO(g)△H=﹣110.5kJmol﹣1 ,
O2(g)═CO(g)△H=﹣110.5kJmol﹣1 ,
2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJmol﹣1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为 .
(3)如图是N2和H2反应生成2mol NH3过程中能量变化示意图,请计算每生成1mol NH3放出热量为 . 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com