
类比推理的方法在化学学习与研究中有广泛的应用,但有时会得出错误的结论。以下几种类比推理结论中正确的是
A.H2SO4为强酸,推出HC1O4为强酸 .
B.Fe3Cl8可以改写为FeCl2·2FeCl3,推出Fe3I8可以改写为FeI2·2FeI3
C.NH3的沸点高于PH3。推出CH4沸点高于SiH4
D.CO2通入Ba(NO3)2溶液中无沉淀生成,推出SO2通入Ba(NO3)2溶液中无沉淀生成
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年山东省高二12月月考化学卷(解析版) 题型:实验题

(I)该硫酸的物质的量浓度是________。
(II)某化学兴趣小组进行硫酸性质的实验探究时,需要240mL1.84mol/L的稀硫酸。可供选抒的仪器由:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙 请冋答下列问题:
(1) 上述仪器中,再配置稀硫酸时用不到的有________ (填代号)
(2) 经计算,需:浓硫酸的体积为_____________。现有:
①10mL ②50mL ③100mL三种规格的量筒,你选用的量筒是______ (填代号)
将上述硫酸迸行稀释的实验操作有:___________________。
(3)在配制稀硫酸过程中,其他操作都准确,能引起误差偏高的有:_________ (填代号)
①洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中
②容量瓶用1moll/L稀硫酸润洗
③转移前,容量瓶中含存少量蒸馏水
④量.取浓硫酸时俯视读刻度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高一上大考二化学卷(解析版) 题型:填空题
Ⅰ.写出碳酸氢钠和次氯酸在水溶液中的电离方程式 、 。
Ⅱ.某无色透明溶液中可能大量存在Ag+、Al3+、Cu2+、Fe3+、Na+中的几种,回答下列问题:
(1)不做任何实验就可以肯定原溶液中不存在的离子是___________。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是_______________。
(3)取(2)中的滤液,加入过量的稀氨水(NH3·H2O),出现白色沉淀,说明原溶液中肯定有___________,有关的离子方程式为______________________。
(4)原溶液可能大量存在的阴离子是下列的___________。
A.Cl- B.NO
C.CO D.OH-
D.OH-
(5)请设计实验证明原溶液中有钠离子(写出详细实验操作过程及现象) __________________。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上调研四化学试卷(解析版) 题型:实验题
在实验室中某实验小组同学关于硫酸铜的制取和应用,设计了以下实验:
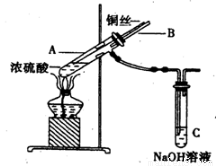
(1)装置A中发生反应的化学方程式为________________________。
(2)为符合绿色化学的要求,某同学进行如下设计:将铜粉在___________(填仪器名称)中反复的灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应,反应后溶液经过_________、___________、过滤、洗法、干燥,即可得到产品CuSO4·5H2O晶体。
(3)将空气或氧气直接通入到钢粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4作催化剂,即发生反应,生成硫酸铜。其反应过程的第2步是:___________,Fe3++Cu==2Fe2++Cu2+,请写出其第1步反应的离子方程式_________________。
(4)制取的CuSO4溶液和“另一物质”在40~50℃混合时生成了一种难溶物质氢化亚铜(CuH)。将CuH溶解在稀盐酸中时生成了一种气体,这种气体是 _____________,经收集测定生成的该气体为标况下11.2 L,则被还原的离子得电子的物质的量是___________。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上调研四化学试卷(解析版) 题型:选择题
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g) + xB(g)  2C(g)。各容器的反应温度、反应物起始量、反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量、反应过程中C的浓度随时间变化关系分别以下表和下图表示:

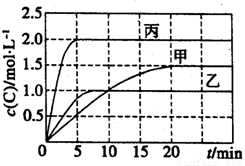
下列说法正确的是
A.10min内甲容器中反应的平均速率v(A)=0.025mol·L-1·min-1
B.由图可知:T1<T2,且该反应为吸热反应
C.若平衡时保持温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上调研四化学试卷(解析版) 题型:选择题
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+==Cu2++5Fe2++2S,反应结束后,经处理获得单质硫x mol。下列说法正确的是
A.反应中硫元素被氧化,所有铁元素均被还原
B.氧化剂是Fe3+,氧化产物是Cu2+
C.反应结束后溶液中三种金属离子的总物质的量为ymol,则原Fe3+的总物质的量为(y-x) mol
D.反应中转移电子的物质的量为xmol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高一12月月考化学试卷(解析版) 题型:选择题
a g Mg、Al合金完全溶解在C1 mol·L-1、V1L HCl溶液中,产生bmolH2。再向反应后的溶液中加入C2 mol·L-1、V2 L NaOH溶液,恰好使沉淀达到最大值,且沉淀质量为d g。下列关系错误的是( )
A.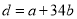 B.C1=C2V2/V1
B.C1=C2V2/V1
C.铝为 (12b-a)/9 mol D.与金属反应后剩余盐酸为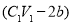 mol
mol
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上月考四化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】
请回答下列问题:
(1)写出硅原子基态时的核外电子排布式:______________。硅元素位于元素周期表的第_________族。
(2)从晶体类型来看,金刚石属于_________晶体。
(3)甲烷分子中碳原子的杂化方式为________。SO42-的空间构型为_______________。
(4)实验测定HF的相对分子质量时,实验测定值一般高于理论值的原因是______________。
(5)NaCl和CsCl熔点高的是 ,(填化学式)其主要原因是 。
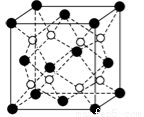
(6)CaF2晶胞结构如图所示,该晶体的密度为a g/cm3,则晶胞的体积是 (只要求列出算式)。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三12月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.碳酸钠溶液呈碱性,可用于治疗胃酸过多
B.浓度相同的NaNO3溶液和HNO3溶液中NO3-化学性质不同
C.钠的金属性比钾强,工业上用钠制取钾(Na+KCl K↑+NaCl)
K↑+NaCl)
D.既有单质参加,又有单质生成的反应一定是氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com