
| A. | 6.4 g | B. | 9.6 g | C. | 19.2 g | D. | 24 g |
分析 Cu和浓硝酸反应过程中,Cu失电子生成铜离子、硝酸得电子生成NO2、N2O4、NO,且转移电子守恒,这些气体若与1.12LO2(标况)混合后通入水中,气体被完全吸收,说明氧气得到的电子等于这些气体生成硝酸根离子得到的电子,所以氧气得到的电子等于Cu失去的电子,根据转移电子守恒得到硝酸铜的物质的量,再根据离子方程式计算加入稀硫酸后溶解的Cu.
解答 解:Cu和浓硝酸反应过程中,Cu失电子生成铜离子、硝酸得电子生成NO2、N2O4、NO,且转移电子守恒,这些气体若与2.24LO2(标况)混合后通入水中,气体被完全吸收,说明氧气得到的电子等于这些气体生成硝酸根离子得到的电子,所以氧气得到的电子等于Cu失去的电子,根据转移电子得n(Cu)=$\frac{\frac{1.12L}{22.4L/mol}×4}{2}$=0.1mol,根据原子守恒得n(Cu)=n[Cu(NO3)2]=0.1mol,再加入稀硫酸后,相当于溶液中含有硝酸,能继续溶解Cu,n(H+)=2n(H2SO4)=2×5mol/L×0.1L=1mol,n(H+):n(NO3- )=1mol:0.2mol=5:1>$\frac{1}{4}$,所以氢离子有剩余,根据硝酸根离子计算溶解铜的质量,
设溶解Cu的质量为x,
3Cu+2NO3-+8H+=3Cu2++2NO+4H2O
192g 2mol
x 0.2mol
192g:2mol=x:0.2mol
x=$\frac{192g×0.2mol}{2mol}$=19.2g,
故选:C.
点评 本题考查根据方程式的计算,明确物质之间的反应是解本题关键,注意进行过量计算,注意转移电子守恒、原子守恒的利用,题目难度中等.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:实验题
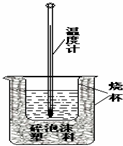 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶 液进行中和热的测定,实验装置如图所示.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶 液进行中和热的测定,实验装置如图所示. | 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
| H2SO4 | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 |
| 2 | 25.9 | 25.9 | 25.9 | 29.8 |
| 3 | 26.4 | 26.2 | 26.3 | 30.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16.9 g BaO2固体中阴、阳离子总数为0.2NA | |
| B. | 标况下,5.6 L NO和5.6 L O2的混合气体中含有的分子数为0.375NA | |
| C. | 标准状况下,11.2 L乙烯含有的极性共价键数目为NA | |
| D. | 100 mL 0.1 mol•L-1的硫酸铝溶液中含有的Al3+为0.02NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,浓硫酸可以用铁制槽罐存放,说明铁与浓硫酸不反应 | |
| B. | 检验氯化氢中是否混有氯气,可采用湿润的有色布条 | |
| C. | 镁在空气中燃烧只生成氧化镁 | |
| D. | 钠可以从硫酸铜溶液中置换出金属铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸钠水溶液显碱性:SO32-+2H2O?H2SO3+2OH- | |
| B. | SO2的水溶液显酸性:SO2+H2O?H2SO3?2H++SO32- | |
| C. | 燃煤时加入石灰石减少SO2排放:2CaCO3+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2 | |
| D. | 浓硫酸处理少量氨气:H2SO4+2NH3═(NH4)2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com