
| A. | 液氯 | B. | 漂白粉 | C. | 臭氧 | D. | 白酒、 |
分析 根据消毒剂能杀菌消毒且不能影响水的酸碱性、不能有毒分析.
A.液氯是有毒物质,能和水反应生成盐酸和次氯酸,次氯酸有强氧化性;
B.漂白粉菌杀菌消毒是利用其强氧化性;
C.臭氧具有强氧化性,能够杀菌消毒;
D.白酒含有乙醇,能够使蛋白质变性,具有杀菌消毒作用.
解答 解:A.液氯能和水反应生成盐酸和次氯酸,次氯酸有强氧化性所以能杀菌消毒,但因有盐酸生成所以影响水质,故A错误;
B.漂白粉菌杀菌消毒是利用了次氯酸钠的强氧化性,次氯酸钠是强碱弱酸盐,所以影响水质,故B错误;
C.臭氧具有强氧化性,所以能杀菌消毒,且不影响水质,故C正确;
D.白酒含有乙醇,能够使蛋白质变性,具有杀菌消毒作用,加入乙醇影响水质,故D错误;
故选:C.
点评 本题考查了饮用水消毒剂的选取,题目难度不大,根据物质的性质分析其用途,注意化学知识的积累.


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨和硝酸都是重要的化学品.
氨和硝酸都是重要的化学品.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性强弱:HClO4>H2SO4>H3PO4>H2SiO3 | |
| B. | 原子半径大小:K>Na>S>O | |
| C. | 熔沸点高低:金刚石>NaCl>H2O>H2 | |
| D. | 还原性强弱:F->Cl->Br->I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鱼、肉、虾等食品用福尔马林防腐保鲜 | |
| B. | 国际奥委会禁止使用的兴奋剂--麻黄碱 | |
| C. | 向伤口处涂一定浓度的双氧水溶液可以杀菌消毒 | |
| D. | 误食铜、汞、铜等重金属,立即喝牛奶或鸡蛋清解毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
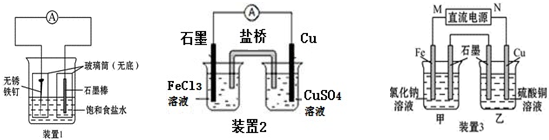
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯乙烷水解制乙醇;丙烯与氯化氢反应 | |
| B. | 乙酸和乙醇制乙酸乙酯;苯与液溴的反应 | |
| C. | 2-氯丙烷制丙烯;由乙炔与溴的反应 | |
| D. | 氯乙烯制聚氯乙烯;由苯乙酸甲酯的水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
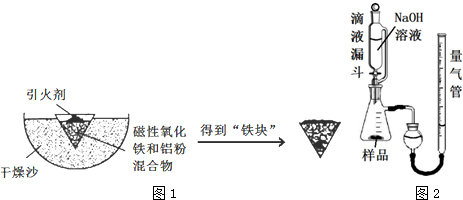
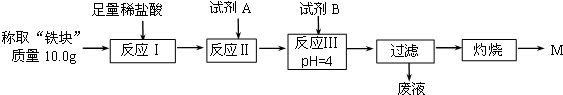
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com